Akvarijní pufry
Tento článek měl být původně o uhličitanovém systému a o tom, čemu říkáme alkalita. Jenže při jeho promýšlení jsem si uvědomil, že fungování uhličitanového systému nemohu vysvětlit a čtenáři nemohou řádně pochopit, pokud si předtím neobjasníme, co přesně znamená další známá veličina, totiž hodnota pH, a jak ji některé látky – pufry – mohou stabilizovat. Odtud už bylo zřejmé, že nemohu psát jen o uhličitanech, nýbrž i o dalších pufrech. Ty v akvaristice také hrají významnou a často přehlíženou roli.
Chemikům se omlouvám za některé nepřesnosti, kterých jsem se dopustil v zájmu zjednodušení výkladu. I tak, obávám se, vznikl text pro mnohého čtenáře jen nesnadno stravitelný. Věřím ale, že je potřebný. Akvaristé sice většinou znají základní pojmy (alkalita, uhličitanová tvrdost, °dKH, atd.), nezřídka je ale chápou jen povrchně a z toho pak vyplývají různé mylné úsudky. Přitom, věřte mi, uhličitany i další pufry hrají v našem koníčku roli dost významnou na to, aby se vyplatilo jim dobře porozumět.
Hodnota pH
Asi každý akvarista ví, že akvarijní voda vždy má nějaké péhá. Co to ale znamená?
Ve vodě, i chemicky čisté vodě, se vždy vyskytují kromě molekul vody (H2O) i ionizované částice H+ – vodíkové kationty, běžně nazývané protony – a OH–, hydroxidové anionty. Vznikají tak, že část molekul vody se rozštěpí, disociuje na H a OH, přičemž ovšem odštěpený vodík přenechá svůj elektron (má jen jeden) skupině OH. Skupina OH proto má kromě „svých“ elektronů ještě jeden elektron navíc. Každý elektron přestavuje jednotkový elektrický náboj, kterému jsme konvencí přiřadili záporné znaménko. Proto píšeme OH– – částice má elektron navíc – a H+ – částici jeden elektron chybí. Vypadá to nelogicky, ale tak je to mezi vědci domluvené a nezbývá, než si na to zvyknout.
Uvedený jev se nazývá autoionizace nebo autoprotolýza vody. Díky přítomnosti iontů, tedy ionizovaných částic, má i chemicky čistá voda vodivost, i když jen nepatrnou (za standardních podmínek 0,055 µS/cm). Nepatrnou proto, že pouze nepatrná část molekul vody disociuje. V čisté vodě je koncentrace obou iontů stejná, a to 10-7 mol/l = 10-7 M = 0,1 µM. Přitom platí, že součin molárních koncentrací iontů H+ a OH– je vždy roven 10-14; říká se tomu iontový součin vody. Ten zůstává zachován i tehdy, kdy jsou ve vodě rozpuštěné i další látky. Počet protonů pak zpravidla není stejný jako počet hydroxidových aniontů, ale součin jejich koncentrací zůstává konstantní. Takže například je-li koncentrace protonů nějakou kyselinou zvýšená na 10-4 M, koncentrace hydroxidových aniontů poklesne na 10-10 M; jejich součin je opět 10-14.
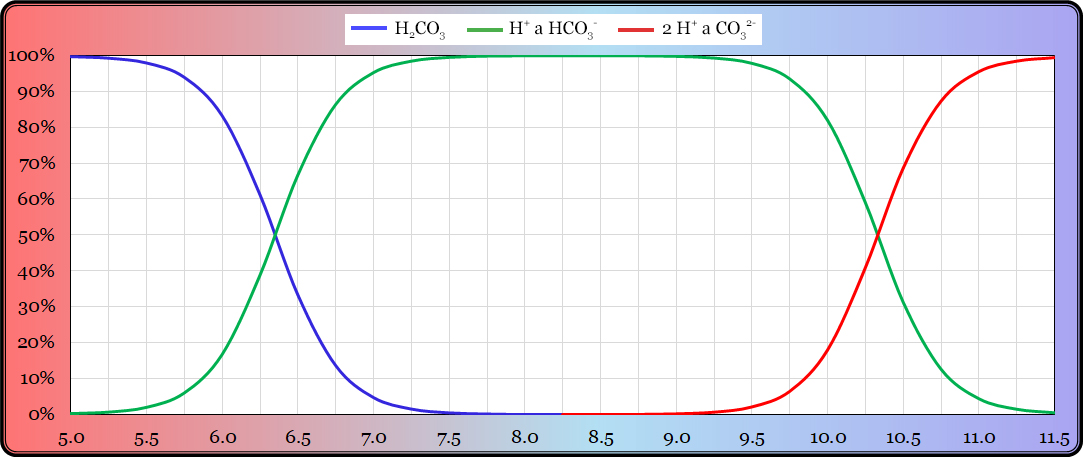
Následující graf to ukazuje názorně:
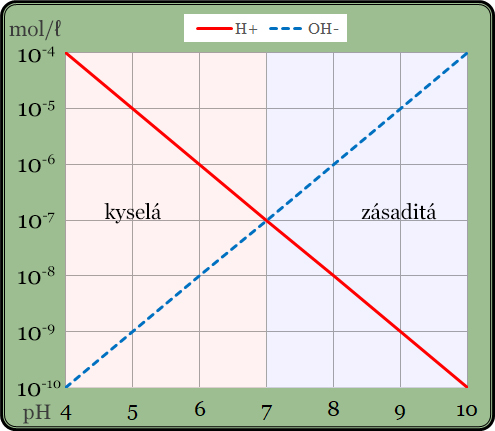
Svislá osa grafu udává molární koncentraci daného iontu a vodorovná hodnotu pH. Je zřejmé, že známe-li koncentraci jednoho z iontů, koncentrace druhého je tím daná. V praxi měříme koncentraci vodíkových kationtů – protonů. Je-li koncentrace protonů vyšší než 10-7 M (např. 10-6 M), což současně znamená, že je vyšší než koncentrace hydroxidových aniontů, pak je voda kyselá. Naopak je-li koncentrace hydroxidových aniontů vyšší než 10-7 M, je jich více než protonů a voda je zásaditá. Je-li koncentrace obou iontů stejná, tedy 10-7 M, voda je neutrální.
A zde už můžeme vidět souvislost s hodnotou pH. Například je-li koncentrace protonů 10-5 mol/l (deset na mínus pátou mol na litr), pak hodnota pH činí pět. Odborným jazykem je hodnota pH definována jako záporná hodnota dekadického logaritmu molární koncentrace vodíkových kationtů. Vzorec vypadá následovně:
pH = –log [H+]
Slovo logaritmus či značka log asi leckoho vyděsí, ale dá se to říct i srozumitelněji: pH je ten exponent nad základem 10, a změní se jeho znaménko. Je-li tedy hodnota pH = 5,85, znamená to, že koncentrace protonů je 10-5,85 M = 1,41 µM.
Je dobré mít neustále na paměti, že souvislost mezi hodnotou pH a koncentrací protonů není lineární, nýbrž exponenciální (jde o číslo v exponentu). S každou jednotkou hodnoty pH se koncentrace protonů zvýší nebo sníží desetinásobně (základem je 10).
Ukažme si to opět graficky:
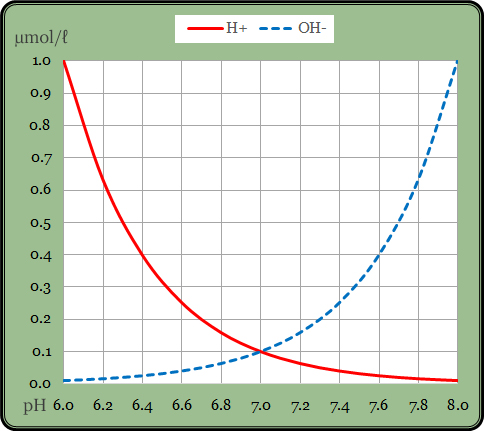
Vodorovná stupnice udává hodnotu pH a svislá koncentraci daných iontů v mikromol na litr (1 µM = 10-6 M; 1 µM je jedna milióntina mol na litr). Na rozdíl od Grafu 1, v tomto grafu není svislá stupnice logaritmická, ale lineární, a znázorněným výsledkem pak není přímka, nýbrž „realistická“ křivka. Molární koncentrace protonů při hodnotě pH=6 je 1 µM, při pH=7 je 0,1 µM a při pH=8 činí 0,01 µM. A třeba při oblíbené hodnotě pH = 6,6 je koncentrace protonů 10-6,6 M = 0,25 µM.
Z uvedeného plynou dva prakticky významné poznatky:
1. Při smíchání dvou stejných množství vody o rozdílné hodnotě pH vznikne voda, jejíž hodnota pH není aritmetickým průměrem původních hodnot (ale je někde mezi nimi).
2. Přidáním stejného množství kyseliny (zásady) do vody nedojde pokaždé ke stejnému snížení (zvýšení) hodnoty pH.
Oba případy lze řešit výpočtem, ale tím se nebudeme zabývat. A to proto, že v akvaristické praxi nepracujeme s jednoduchými roztoky. Akvarijní voda je vždy směsí mnoha různých rozpuštěných látek v různých koncentracích, z nichž každá se chová trochu jinak a více či méně ovlivňuje hodnotu pH i její stabilitu. Přesný výpočet je v naší praxi nemožný.
Jak fungují kyseliny a zásady
Kyselina je sloučenina, která ve vodě disociuje tak, že zvyšuje počet vodíkových kationtů. Tak například kyselina chlorovodíková disociuje takto:
HCl –> H+ + Cl–
Kyselina chlorovodíková odštěpuje jen jeden proton, a taková kyselina se nazývá jednosytná. Příkladem dvojsytné kyseliny je kyselina sírová. Ta disociuje následovně:
H2SO4 –> 2 H++ SO42-
Vznikají dva protony a jeden síranový anion, který má dva elektrony navíc (proto „2-“ v horním indexu).
Obdobně zásady při disociaci zvyšují počet hydroxidových aniontů. Například hydroxid sodný disociuje takto:
NaOH –> Na+ + OH–
Disociace hydroxidu vápenatého vypadá následovně:
Ca(OH)2 –> Ca2+ + 2 OH–
Jak fungují pufry
Prozatím jsme předpokládali, že kyseliny a zásady plně, stoprocentně disociují. Nyní si ale znovu uvědomme, že kyseliny samy o sobě vlastně nejsou kyselé; kyselost tvoří vodíkové kationty H+, které vznikají při disociaci kyselin. Pokud kyselina nedisociuje, kyselost se netvoří, hodnota pH neklesá. Analogicky totéž platí u zásad.
Takzvané silné kyseliny a zásady za normálních podmínek plně disociují. Kromě nich ale existuje i mnoho méně silných až slabých kyselin a zásad. Ty disociují jen za určitých podmínek a ve větší či menší míře.
Ukažme si to na příkladu kyseliny octové:
CH3COOH <–> H+ + CH3COO–
Kyselina octová je jednosytná kyselina a disociuje na jeden proton a octanový anion. Ale ne vždy – pouze když je hodnota pH roztoku vyšší než cca 6,0. Naopak je-li rozpuštěná v roztoku, který má hodnotu pH nižší než cca 3,5, nedisociuje prakticky vůbec. Já osobně si to racionalizuji tak, že slabá kyselina „necpe“ do roztoku další protony, když už jich tam je podle jejího názoru více než dost.
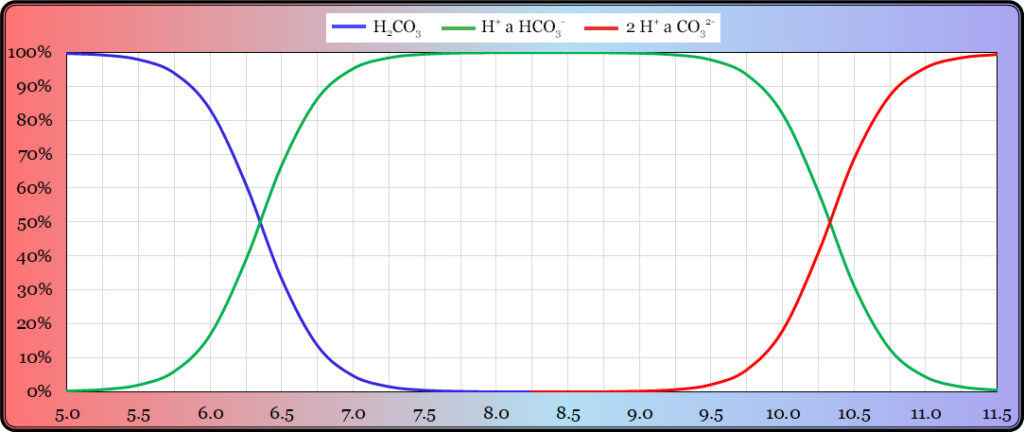
Disociační konstanta kyseliny octové pKA = 4,76. To je hodnota pH, při které disociuje právě jedna polovina kyseliny. Toto číslo postačuje k tomu, abychom mohli sestrojit tzv. disociační diagram kyseliny. Disociační diagram kyseliny octové je znázorněn v Grafu 3. Dobře si ho prohlédněme:
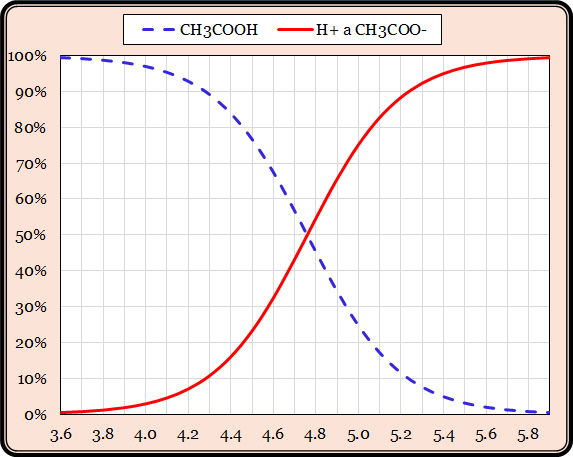
Vodorovná osa označuje hodnotu pH, svislá osa podíl obou forem na celkovém obsahu kyseliny. Dejme tomu, že na začátku má roztok hodnotu pH = 3,6. Kyselina octová v něm obsažená prakticky nedisociuje a ke kyselosti roztoku (tedy koncentraci protonů H+) nijak nepřispívá. Když do takového roztoku přidáváme silnou zásadu, hodnota pH bude stoupat.
Jenže pozor! Kyselina octová v tom okamžiku začne částečně disociovat, zvyšovat koncentraci protonů, a negovat tak vliv přidané zásady. Přidaná silná zásada nezvedne hodnotu pH zdaleka tolik, jak bychom předpokládali. Kyselina octová bude působit jako pufr. Projeví se její zásadová neutralizační kapacita (ZNK).
Budeme-li dále přidávat silnou zásadu, hodnota pH bude nadále stoupat jen pomalu, protože další kyselina octová bude disociovat. A to asi až do hodnoty pH = 5,9. V tu chvíli už bude prakticky všechna kyselina octová disociovaná a její ZNK bude vyčerpána. Poté už přidání i malého množství silné zásady bude hodnotu pH rychle zvyšovat.
Nelze ale prostě říct, že kyselina octová má ZNK. Ona totiž vykazuje i kyselinovou neutralizační kapacitu (KNK), která se projeví, budeme-li přidáváním silné kyseliny okyselovat roztok kyseliny octové z hodnoty pH = 5,9 níže. Proces je opačný – zpočátku disociovaná kyselina octová bude postupně protonována:
H+ + CH3COO– <–> CH3COOH
Přijímáním protonů (protonací) bude octanový anion tlumit okyselování roztoku. Tento tlumivý účinek bude pokračovat až do pH ≈ 3,6, kdy bude kyselina octová téměř plně ve své nedisociované formě a její KNK bude vyčerpána.
Pufrační neboli tlumivá kapacita kyseliny octové se tedy projevuje zhruba v rozmezí hodnot pH od 3,6 do 5,9 – v tomto pásmu bude kyselina octová zmírňovat výkyvy hodnoty pH oběma směry. Ze strmosti křivky patrné z disociačního diagramu vidíme, že nejsilněji bude pufrovat v oblasti hodnoty pH asi 4,5 až 5,0, tedy blízko hodnoty její disociační konstanty pKA = 4,76. Tento princip platí pro všechny pufry.
Na čem dalším pufrační efekt závisí? Na teplotě a tlaku, ale tím se nemusíme zabývat, protože při našem koníčku pracujeme skoro pořád v blízkosti tzv. standardních podmínek – při teplotě 25 °C a normálním atmosférickém tlaku. Kromě toho ovšem reálná pufrační kapacita závisí na množství pufru. Logicky, čím více ho v akváriu je, tím více kyseliny nebo zásady musíme použít, abychom jeho pufrační kapacitu překonali.
Povšimněte si, že jsem se v předchozích větách vyhnul termínu koncentrace. Pufrační kapacita samozřejmě závisí na koncentraci pufru, jenže abychom to neměli tak jednoduché, některé pufry v závislosti na hodnotě pH přecházejí z plynné do kapalné nebo pevné fáze a zpět, ba některé pufrační jevy jsou spojeny přímo s pevnými látkami v akváriu. V takovém případě o jejich koncentraci hovořit dost dobře nemůžeme.
Uhličitanový systém
Ukázali jsme si, jak kyselina octová funguje jako pufr. Tato kyselina se v akváriích vyskytuje v malém množství, takže i její pufrační účinek je malý. Jsou však látky, které jsou v našich akváriích přítomny vždy nebo téměř vždy ve značném množství a svojí pufrační kapacitou dění v akváriu ovlivňují zásadně. Z nich na prvním místě musíme zmínit kyselinu uhličitou (H2CO3).
Oproti kyselině octové je působení kyseliny uhličité ve vodě hned z několika důvodů složitější. Tak za prvé, kyselina uhličitá je dvojsytná, takže napřed uvolňuje (či přijímá) jeden proton, poté druhý:
H2CO3 <–> H+ + HCO3– <–> 2 H+ + CO32-
Disociační konstanty kyseliny uhličité jsou pKA1 = 6,35 a pKA2 = 10,33 (viz Graf 4). V okolí těchto hodnot pH se pufrační efekt projevuje nejsilněji. Většina vod u nás má hodnotu pH někde v rozmezí 6,5 až 8,0 a hydrogenuhličitany (HCO3–) jsou převládající formou. Jejich obsah běžně dosahuje desítek mg/l a uhličitanový systém tak mezi pufry jasně dominuje.
Druhou zvláštností je, že jen malá část – asi 1 % – oxidu uhličitého s vodou reaguje za vzniku kyseliny uhličité:
CO2 + H2O <–> H2CO3
Zbývající část oxidu uhličitého zůstává ve volně hydratované formě (CO2·H2O), fakticky jde o rozpuštěný CO2. Tato skutečnost má pro život v akváriu náramný význam, ale z hlediska pufrační funkce jen podružný – ovlivňuje reakční rychlost, nikoli pufrační kapacitu. Pro tu můžeme veškerý tzv. volný oxidu uhličitý (CO2 a H2CO3) pokládat za kyselinu uhličitou. Pouze při měření alkality musíme na výsledky pár minut počkat než se roztok stabilizuje.
S tím souvisí další zvláštnost uhličitanového systému. Protože oxid uhličitý je plyn obsažený v ovzduší, jeho obsah ve vodě zůstává konstantní a je daný parciálním tlakem CO2 ve vzduchu. Za standardních podmínek činí asi 0,5 mg/l. Až při hodnotě pH vody blízké 8,0 obsah CO2 ve vodě rychle klesá a asi od hodnoty 8,3 jej můžeme pokládat za nulový. (Oxid uhličitý proniká z okolí do vody ovšem i tehdy, ale vzhledem k hodnotě pH se prakticky všechen rovnou přeměňuje na protony a hydrogenuhličitany.)
Když tedy například běžnou vodovodní vodu (pH > 7) okyselíme silnou kyselinou, dojde k protonaci hydrogenuhličitanů na nedisociovanou kyselinu uhličitou. Většina nedisociované kyseliny uhličité se ale přemění na rozpuštěný oxid uhličitý. Ten ve vodě zůstane jen přechodně a srovná svoji koncentraci s koncentrací danou parciálním tlakem oxidu uhličitého v ovzduší. Výsledkem je, že sice trvale snížíme alkalitu a hodnotu pH, ale jen dočasně zvýšíme obsah CO2 ve vodě.
Praktický příklad:
Tuzemští akvaristé často stojí před problémem, že z vodovodu jim teče voda s hodnotou pH vyšší, než jakou si přejí mít.
Dejme tomu, že máme vodu o hodnotě pH = 7,4 a chceme mít pH = 6,6. Uhličitanová tvrdost činí 4 °dKH, tj. asi 87 mg/l HCO3–. Okyselíme tedy vodu nějakou silnou minerální kyselinou. Doporučím spíše kyselinu sírovou než chlorovodíkovou, protože ta druhá uvolňuje korozivní, nepříjemné a zdraví škodlivé výpary (plynný chlorovodík).
Opatrně přidáváme kyselinu a dlouho se neděje skoro nic. Je to proto, že obsažené hydrogenuhličitany jsou protonovány na nedisociovanou kyselinu uhličitou. Dochází současně ke dvěma reakcím:
H2SO4 –> 2 H+ + SO42-
HCO3– + H+ –> H2CO3
Kyselina sírová disociuje a zvyšuje obsah protonů, tedy okyseluje vodu, jenže současně s poklesem hodnoty pH hydrogenuhličitany protony přijímají a přeměňují se na nedisociovanou kyselinu uhličitou. (A ta vzápětí na CO2.)
Výsledkem je, že hodnota pH klesá pomalu, dokud se obsah hydrogenuhličitanů nevyčerpá. Pak ovšem voda na přidání další kyseliny reaguje velmi citlivě – už není pufrovaná. Odtud pochází akvaristická tradice, že uhličitanová tvrdost by neměla být příliš nízká (< 1-2 °dKH).
V našem příkladu bychom žádaného snížení hodnoty pH ze 7,4 na 6,6 dosáhli přidáním kyseliny sírové v množství 697 µM, tedy asi 68 mg/l. To je ovšem jen laboratorní teorie. V akvarijní realitě výpočty většinou příliš nesedí, a záhy se dozvíme proč.
Uhličitanová tvrdost, alkalita, KNK4,5
Obsah hydrogenuhličitanů se normálně neměří. Namísto toho se ve vodárenské praxi měří kyselinová neutralizační kapacita vody do hodnoty pH = 4,5, značka KNK4,5. Tahle hodnota pH byla zvolena proto, že při ní můžeme již všechny (hydrogen)uhličitany pokládat za přeměněné na nedisociovanou kyselinu uhličitou, voda tedy žádné (hydrogen)uhličitany neobsahuje a pufrační kapacita uhličitanového systému je zcela vyčerpána. I všechny akvarijní testy alkality (UT) fungují na stejném principu.
KNK4,5 běžně, i když nepřesně označujeme jako alkalitu vody, a ještě méně přesně jako uhličitanovou tvrdost (UT). Měří se v mol/l (v praxi nejčastěji v mmol/l, tedy v milimol na litr, 1 mol = 1000 mmol) a odpovídá molárnímu množství silné jednosytné kyseliny kterou musíme přidat do litru vody, aby hodnota pH klesla na 4,5. Pokud voda žádné další pufry neobsahuje, naměřená hodnota přesně odpovídá počáteční molární koncentraci hydrogenuhličitanových aniontů (HCO3–). Všiml jsem si, že leckterá vodárna ve svých údajích bez dalšího ztotožní KNK4,5 s obsahem hydrogenuhličitanů. Je to nepřesnost, ale v případě pitné vody většinou malá. Akvarijní voda je však bohatá i na další pufry a tohle zjednodušení neplatí: v akvaristické praxi nemůžeme KNK4,5 čili alkalitu ztotožňovat s obsahem (hydrogen)uhličitanů čili uhličitanovou tvrdostí.
Akvaristé nejsou zvyklí na molární jednotky a měří alkalitu v německých stupních uhličitanové tvrdosti – °dKH. Pro přepočet jednotek platí vzorce:
1 °dKH = 356,65 µmol/l = 21,762 mg/l HCO3–
1 mmol/l = 2,804 °dKH = 61,017 mg/l HCO3–
1 mg/l HCO3– = 16,389 µmol/l = 0,046 °dKH
Existuje závislost mezi hodnotou pH, uhličitanovou tvrdostí a obsahem CO2 ve vodě. První a druhé měřit umíme, třetí zpravidla ne (přístroje na měření obsahu CO2 jsou drahé). Proto se někdy obsah CO2 ve vodě stanovuje výpočtem:
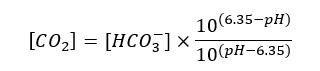
Hranaté závorky označují molární koncentraci, pH ve vzorci znamená naměřenou hodnotu pH. Pro přepočet jednotek použijeme vzorce uvedené výše, plus následující:
1 mmol/l CO2 = 44,0095 mg/l CO2
1 mg/l CO2 = 22,7224 µmol/l CO2
Alternativní možností je nahlédnout do tzv. Tillmansovy tabulky, kde najdeme čísla již vypočítaná a většinou i rovnou převedená na důvěrně známé miligramy na litr.
Čísla jsem uvedl s přesností na čtyři místa za desetinnou čárkou, ale taková akurátnost je v naší praxi docela zbytečná. Důvody jsou dva. Za prvé, měříme-li alkalitu běžným akvaristickým testem s přesností na 0,5 °dKH, odchylka je dost nepříjemná. O poznání přesnější způsob měření alkality popsal kolega František Roztočil v Akváriu č. 42.
Druhý důvod je závažnější; v akvarijní vodě, potažmo v akváriu jako systému se vyskytují ve významném množství různé pufry, ne jen uhličitany. O nich si povíme níže. Napřed se ale zastavme u otázky, která se v diskusích často objevuje:
Kolik CO2 je (či může být) v přírodních vodách?
V přírodních vodách je běžně koncentrace rozpuštěného oxidu uhličitého vyšší než koncentrace daná parciálním tlakem CO2 v ovzduší, tedy ≈ 0,5 mg/l. Zdrojem CO2 je respirace vodních organismů. Ta probíhá v principu takto:
C6H12O6 + 6 O2 –> 6 CO2 + 6 H2O
Z rovnice vidíme, že vznik jedné molekuly CO2 je spojen se spotřebou jedné molekuly O2, tedy že úměrně objemu respirace klesá obsah kyslíku ve vodě. To ukazuje Graf 5:
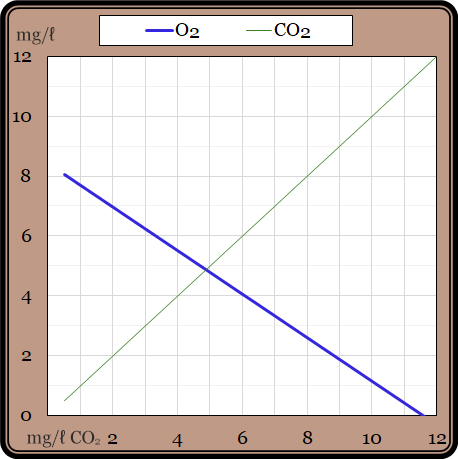
Vodorovná osa odpovídá obsahu CO2 v mg/l a svislá udává obsah O2 v mg/l. Čísla platí při teplotě 25 °C. Platí předpoklad, že výměna obou plynů na hladině vody je stejně rychlá.
A tak na grafu vidíme, že „neživá“ voda bez vodních organismů obsahuje asi 8 mg/l O2 a 0,5 mg/l CO2. V závislosti na přítomnosti organických látek se v „živé“ vodě rozmnoží organismy a respirují – obsah O2 klesá, obsah CO2 stoupá. Dosáhne-li koncentrace CO2 6 mg/l, obsah kyslíku poklesne na úroveň 4 mg/l, a to je již prostředí dosti nepříznivé pro život ryb i vyšších rostlin. A při koncentraci CO2 10 mg/l činí obsah O2 jen 1 mg/l. To pak je spíše jen páchnoucí stoka.
Existuje cesta ven z této závislosti? Anebo jinak: mohou se rostliny v přírodě setkat s prostředím s vyšší koncentrací oxidu uhličitého a současně s dostatečným obsahem kyslíku? Odpověď je kladná, takové situace existují.
První z nich je chladná voda. S klesající teplotou docela znatelně stoupá rozpustnost obou plynů ve vodě a jejich obsah je vyšší. Vzájemná závislost obsahu obou plynů nadále platí, ale čísla jsou o poznání příznivější.
Nejednoznačný je vliv fotosyntézy. Při dobrém světle a hustém porostu řas a/nebo rostlin může odpoledne dojít až ke značnému přesycení vody kyslíkem. Respirace pak v noci začíná z koncentrace O2 ne 8, nýbrž třeba 12 mg/l. Pokles obsahu kyslíku nad ránem pak snad nemusí být tak výrazný, a to i přes to, že řasy a rostliny v noci zvyšují objem respirace.
Další případy jsou lokální nepravidelnosti. Jsou to jednak zdroje hlubinné vody, tedy prameny. Podzemní voda může obsahovat i desítky mg/l CO2. Taková voda pochopitelně uvolňuje nadbytečný oxid uhličitý do ovzduší, ale stav přesycení může trvat dost dlouho a dosáhnout daleko od prameniště. Rostliny se tak mohou těšit z extra dávky uhlíku.
Obsah CO2 bývá zvýšený také v místě soutoku dvou vod – jedné kyselé a druhé s vyšším obsahem (hydrogen)uhličitanů. Jak se voda okyseluje, hydrogenuhličitany jsou protonovány na kyselinu uhličitou, fakticky na rozpuštěný CO2. Takové místo může být mimořádně příznivé pro ponořené rostliny.
Důležité je však si povšimnout toho přívlastku „mimořádně“. Vždy jde o lokality svým rozsahem omezené. Nevím o akvarijní rostlině, která by na takových výjimkách postavila svou životní strategii. Dovedu si ale představit, že existují bahenní rostliny, které déletrvající zaplavení nesnesou, ale s takovouto lokálně zvýšenou nabídkou CO2 přežívají pod hladinou třeba řadu měsíců, než voda opadne. To by mohly být případy těch rostlin, jejichž vhodnost pro akvaristiku je sporná a v akváriích přežívají jen s podporou sycení CO2.
Rád bych ale podotkl, že podle mé zkušenosti je takových rostlin v našich akváriích podstatně méně, než se obvykle předpokládá. Je to spíše jen pár raritních druhů. Akvaristické atlasy u spousty rostlin uvádějí sycení CO2 jako nutnou podmínku, ale praxe mnohých pěstitelů ukazuje něco jiného.
Co se děje, když přidáváme CO2?
Běžně říkáme, že oxid uhličitý okyseluje vodu. A celkem není důvod proti tomu namítat, protože prakticky to tak funguje. Skutečnost je ale trochu složitější.
Zvýšíme-li sycením obsah CO2 ve vodě, jeho část reaguje s vodou za vzniku kyseliny uhličité:
CO2 + H2O –> H2CO3
My sice víme, že takto reaguje jen asi 1 % oxidu uhličitého, ale viditelný efekt to nemá; ať obsah CO2 stoupá nebo klesá, vždy se obnoví rovnováha 99 CO2 : 1 H2CO3. Pokud je ale hodnota pH vyšší než cca 4,5–5,0, což je normální situace, kyselina uhličitá bude disociovat:
H2CO3 –> HCO3– + H+
Zvyšuje se tedy koncentrace hydrogenuhličitanů a odštěpují se protony, zdroje okyselení vody. Je to v rozporu s tím, co nám říká praktické pozorování: „CO2 snižuje pH, (hydrogen)uhličitany pH zvyšují.“ Zde ale vidíme, že se vznikem hydrogenuhličitanů vznikají i protony, zdroje kyselosti. Odkud ten rozpor?
Vysvětlením je jiný jev, se kterým se běžně setkáváme: rozpouštění vápence, tedy reakce uhličitanu vápenatého (CaCO3) s hydrogenuhličitany:
CaCO3 + H+ + HCO3– –> Ca2+ + 2 HCO3–
Vidíme, že výsledkem je zvýšení koncentrace hydrogenuhličitanů, jenže jeden proton se přitom ztratil. A máme na paměti, že pouze protony a nic jiného způsobují kyselost. Takže rozpouštěním vápence, který je hlavním zdrojem uhličitanů v přírodních vodách, se obsah hydrogenuhličitanů i hodnota pH zvyšuje.
Organické pufry
V literatuře občas nacházíme údaje o přírodních vodách, kdy hodnota pH nejde dohromady s údajem o uhličitanové tvrdosti. Dám příklad: hodnota pH = 6,4, UT = 2 °dKH. To nevypadá nijak podezřele, ale výpočtem lze zjistit, že v takové vodě by muselo být 28 mg/l CO2. Ejhle, zastánci teorie vysokých koncentrací CO2 v přírodních vodách mají důkaz.
Jenže nemají. Je to jinak.
Podobná data lze nalézt např. v knize Christel Kasselmann Aquarienpflanzen. Autorka uvádí, že analýzy vody prováděly laboratoře firmy Tetra, což by mělo být zárukou profesionality. A dá se docela snadno dovodit, jak k pochybení došlo. Laboratoř určitě změřila KNK4,5 správně a podle zavedených standardů. Tedy výsledek vyjádřila v molárních jednotkách. Jenže paní Kasselmann rozumně usoudila, že její čtenáři-akvaristé by se v molárních jednotkách neorientovali a převedla je na běžně užívané německé stupně. Odtud zbýval už jen krok – původně změřená KNK4,5 se v její knize změnila na Karbonathärte (uhličitanovou tvrdost) udanou v °dKH.
Problém je v tom, že uhličitanová tvrdost není totéž co KNK4,5! Uhličitanová tvrdost znamená obsah (hydrogen)uhličitanů, zatímco KNK4,5 (alkalita) se vztahuje k celkové pufrační kapacitě vody. Na té se uhličitany pouze podílejí, podle okolností z větší či menší části. A pravda je taková, že v mnoha tropických (a akvarijních) vodách platí spíše to druhé: obsah hydrogenuhličitanů je nízký až velmi nízký a jako pufry dominují organické látky. Proto v měkkých vodách nemůžeme z hodnoty pH a alkality dovozovat obsah CO2.
Organických látek – rozpuštěných i nerozpuštěných – je v akváriu vždy mnoho, a i když to okem nevnímáme, rozpuštěné látky jasně převládají nad pevnými (detritem). Přitom jejich značná část – troufám si říct až většina – spadá do kategorie slabých kyselin či slabých zásad. Shora jsme probírali příklad kyseliny octové. Ta je běžným (mezi)produktem mikrobiálního metabolismu a určitě se vyskytuje v každém akváriu. Pravda, není jí mnoho, jenže není sama; podobných látek je spousta. Dejme tomu taková trojsytná kyselina citronová se obvykle vyskytuje v poněkud vyšších koncentracích a její disociační konstanty jsou pKA1 = 3,15, pKA2 = 4,77 a pKA3 = 6,40. V těchto oblastech pufruje vodu.
Převažují však vysokomolekulární organické látky, zejména třísloviny a huminové látky. Oboje si zpravidla spojujeme s nažloutlým až hnědým zabarvením vody, ale jejich obsah ve vodě je významný i při nižších koncentracích, kdy vodu viditelně nebarví. (Bývají i v pitné vodě v množství jednoho až několika mg/l.) Jejich velké a složité molekuly mají mnoho tzv. funkčních skupin, z nichž mnohé mohou za určitých okolností odštěpovat ionty H+ nebo OH–. Převažuje odštěpování protonů, proto jsou tyto látky svým charakterem převážně kyselé. Disociační konstanty dost dobře nelze stanovit; jde o velmi početnou skupinu látek s nepřeberným množstvím různých komponent a vazeb, které se navíc neustále přeměňují. Funguje to prostě tak, že při stoupající hodnotě pH uvolňují více a více protonů. A naopak. Jsou to výborné pufry.
I pevné organické látky – detrit, ale třeba i dřevěné dekorace, kokosové skořápky, rašelina v substrátu apod. – se v menší míře na pufrační kapacitě podílejí. Reakce, tedy uvolňování a přijímání iontů se odehrávají na jejich površích.
Ovšem jak upozorňuje Wetzel ve své Limnologii (viz Akvárium č. 63), omezování označení „detrit“ pouze na pevné látky je vlastně nesprávné, protože neživá organická hmota ve vodním prostředí neustále nějak reaguje a často mění svou fázi z pevné na rozpuštěnou a naopak. Mezi akvaristy se takové pojetí asi sotva ujme, ale hodí se poznamenat, že vidíme-li v akváriu „detrit“, můžeme si být jisti, že ještě mnohem více neživé organické hmoty je rozpuštěné ve vodě. K tomu přičtěme planktonní mikroorganismy a vidíme jasně, proč mají výměny vody takový význam.
Čím okyselit vodu?
Pomineme-li možnost sycení vody oxidem uhličitým, kterou jsem rozebral výše, máme na výběr ze dvou velkých skupin kyselin – organických a minerálních.
Mnozí akvaristé zkoušeli jednoduché organické kyseliny, např. octovou, citronovou, vinnou atd. Problémem je, že tyto látky jsou pochoutkou (snadno dostupným zdrojem uhlíku) pro heterotrofní mikroby. V akváriu s hojností ostatních živin (dusíku, fosforu aj.) bývá následkem mikrobiální zákal spojený s nebezpečným poklesem obsahu kyslíku. Pokud zákal nenastane, signalizuje to pozvolnější rozklad těchto kyselin, nicméně k dekompozici za vzniku vody a oxidu uhličitého dojde vždy. Účinek na hodnotu pH je tedy přechodný a spojený s riziky.
Vodu okyselují i výluhy z rašeliny (huminové látky), olšových šištic (třísloviny) a podobných materiálů. Jako u všech přírodnin, otázkou je čistota a dávkování je obtížné. Účinky těchto látek jsou komplexní a někdy příznivé.
Pak máme minerální kyseliny. Vím o akvaristech, kteří používají k okyselení vody kyselinu fosforečnou a tvrdí, že s tím nemají problémy. Věřím jim, ale mně se z hlediska biologické stability nezdá vhodné dávkovat klíčovou a normálně nedostatkovou živinu (fosfor) v takovém množství. Navíc hrozí polapení kovových mikroprvků v nerozpustných fosforečnanech (FePO4 aj.).
Máme čistší a bezpečnější možnosti: kyseliny sírovou a chlorovodíkovou. S nimi dodáme kromě protonů jen síranové (SO42-) nebo chloridové (Cl–) anionty, kterých bývá ve vodě beztak dost a žádné problémy nezpůsobují.
Další minerální pufry
V pojednáních o alkalitě bývají vedle uhličitanů zmiňovány další minerální látky, které také mohou alkalitu zvyšovat. Jsou to většinou křemičitany, boritany a fosforečnany.
Kyseliny ortokřemičitá (H4SiO4) a metakřemičitá (H2SiO3) jsou slabé kyseliny a jejich disociační konstanty nejsou jednoznačně určeny, protože se jedná o slabě rozpustné a nestabilní látky, které navíc často polymerují. Pro kyselinu ortokřemičitou se uvádějí disociační konstanty pKA1 = 9,5 a pKA2 = 12,6. Kyselina metakřemičitá se vyskytuje spíše jako gelový oxid křemičitý (SiO2·nH2O) než jako definovaná molekula. Její disociační konstanta je asi pKA ≈ 9,7-10,2. Jako pufry budou křemičitany každopádně působit pouze v zásadité oblasti. V některých vodách, a to zejména zásaditých (křemen a křemičitany se v nich lépe rozpouštějí) jich ale může být docela dost, a pak mohou působit zejména svojí ZNK, tedy zmírňovat růst hodnoty pH.
V podobném rozsahu hodnot pH působí jako pufr i kyselina boritá (H3BO3, pKA1 = 9,24, pKA2 = 12,74, pKA3 = 13,80). Její obsah je ale vždy nízký a pufrační efekt zanedbatelný.
Fosforečnany, tedy soli kyseliny fosforečné (H3PO4) mohou hrát určitou roli pouze v případech, kdy jimi akvarista nemírně hnojí (pKA1 = 2,16, pKA2 = 7,21, pKA3 = 12,67). Za normálních okolností jsou fosforečnany rychle přijímány přítomnými organismy a zakomponovány do organických sloučenin. Je-li fosfor do akvária dodáván převážně s krmivem, platí to dvojnásob, protože fosforečnany zůstanou nevyužité pouze tehdy, jsou-li ostatní živiny v relativním nedostatku; s krmivy bohatými na proteiny (čili dusík) se to nejspíš nestane.
Z dalších minerálních látek stojí za zmínku dva plyny: sulfan a amoniak. Sulfan (H2S) obsahuje dva vodíkové atomy, ale odštěpuje jen jeden proton:
H2S <–> HS– + H+, pKA = 7,00.
Amoniak (NH3) naopak jeden proton přijímá:
NH3 + H2O <–> NH4+ + OH–, pKA = 9,24.
Tyto plyny jsou v akvaristice významné a vždy je v akváriu máme, jako pufry se ale vzhledem k nízkým koncentracím výrazněji neprojevují, leda snad v substrátu.
Významná změna nastala s masovým zavedením speciálních akvarijních substrátů. Ty skoro všechny obsahují jíly s velkou kationtovou výměnnou kapacitou (KVK).
Otázka jílů (a jim podobných zeolitů) jako měničů kationtů je náramně komplikovaná, protože odvisí od mnoha proměnných. Navíc jílů je mnoho druhů, z nichž každý se chová trochu jinak, a s čistými jíly se setkáme pouze v laboratorních podmínkách. Nelze tedy očekávat, že si pořídíme nějaký konkrétní jíl s jasně specifikovanými pufračními vlastnostmi.
Vždy ale platí, že jedním z kationtů, které jíly přijímají nebo uvolňují, je vodíkový kation H+. Ten většinou není prioritní volbou jílů, ale jedním z faktorů, které přijímání kationtů ovlivňují, je jejich koncentrace v okolním roztoku. A tak lze říct, že v prostředí kyselé vody, tedy s vysokou koncentrací protonů, je vyšší pravděpodobnost, že jíl nějaké protony přijme a uvolní za ně jiné kationty. Bude tak zmírňovat kyselost čili bude vykazovat KNK.
A naopak v zásaditém prostředí, kde je protonů v roztoku málo, je vyšší pravděpodobnost, že jíl protony uvolní a přijme za ně nějaké jiné kationty. Tak bude zmírňovat zásaditost okolní vody čili bude vykazovat ZNK.
Pufrační schopnosti jílů jsou v akvaristické praxi docela dobře ověřené, i když málo pochopené. Tzv. japonské substráty vodu pufrují právě mj. díky obsahu jílů, pravděpodobně předpřipravených loužením v silné kyselině (aby přijaly nadnormální množství protonů). I jiné komerčně dostupné jíly a zeolity (např. podestýlky pro domácí zvířata, anebo moje oblíbené vinařské jíly) mají pufrační účinek. Problém je, že nejsou předem připravené a vyzkoušené pro použití v akvaristice, takže nevíme, k jaké hodnotě pH budou vodu pufrovat, ani které kovové kationty (nebo amonný kation NH4+) budou přednostně vázat či uvolňovat.
Problematika iontové výměnné kapacity (ano, existují i látky s aniontovou výměnnou kapacitou, AVK) úzce souvisí s jevem adsorpce. V jednotlivých případech je dokonce obtížné určit, o který z obou jevů se vlastně jedná. Látky adsorbující čili adsorbenty – minerální i organické – na svých površích vážou jiné látky, do té doby rozpuštěné, a odstraňují je tak z roztoku. Velmi často jde o ionty, tedy částice s nenulovým elektrickým nábojem, a jejich zmizení z roztoku, eventuálně nahrazení něčím jiným (mnohdy přímo H+ nebo OH–), může přímo nebo zprostředkovaně ovlivnit hodnotu pH. A opět často platí to, co jsem uvedl o jílech: v kyselých podmínkách je vyšší pravděpodobnost reakcí zmírňujících kyselost, v zásaditých zmírňujících zásaditost.
Adsorpční jevy jsou technologicky významné (mj. v oboru čištění vod) a intenzivně zkoumané. Zkoušel jsem to studovat, ale myslím, že podrobnosti pro nás akvaristy valný význam nemají. Postačí vzít na vědomí, že adsorbenty vždy v akváriu máme, v nemalém množství a mnoho různých druhů. Každý z nich funguje jinak, ale v součtu je zřejmá tendence zmírňovat výkyvy hodnoty pH, a tak působit jako svého druhu pufr.
Akvárium jako pufr
Mezi akvaristy se traduje, že voda s nízkou alkalitou (méně než 2 °dKH) je náchylná k prudkým výkyvům hodnoty pH, a tedy nevhodná, nestabilní. S tím bych mohl vcelku i souhlasit, ale mám důležité doplňující poznámky:
Za prvé, mírné výkyvy hodnoty pH nejsou katastrofou. Není to nic, co by sladkovodní organismy z přírody neznaly. Ano, obvykle preferují takovou či onakou hodnotu, ale ta osciluje okolo nějakého středu. Denní a roční rytmy a změny počasí hodnotu pH běžně vychylují oběma směry.
Za druhé, opakuji, nesmíme zaměňovat alkalitu (KNK4,5) za uhličitanovou tvrdost (UT). Je pravda, že i pokud používáme demineralizovanou vodu, nějaké hydrogenuhličitany se v ní vždy vytvoří. Kontaktu s oxidem uhličitým nemůžeme zabránit a je-li hodnota pH vyšší než cca 5, jeho část se přemění na disociovanou kyselinu uhličitou, tedy H+ + HCO3–. Je jí však mnohem méně, než odpovídá 1 °dKH.
Nevadí. Mám s kyselou a měkkou vodou (15–50 µS/cm) bohaté zkušenosti a s výkyvy hodnoty pH nemám starosti; další pufry působí velmi dobře. Až moc. Každé z mých akvárií směřuje k nějaké hodnotě pH, kterou pokládá za „správnou“, obvykle o něco blíž k neutrálnímu bodu, než bych si přál.
Podle mojí zkušenosti jsou náhlé a výrazné změny hodnoty pH rizikem jen v čerstvě zařízených akváriích s praným pískem jako substrátem. Za pár měsíců se v akváriu nahromadí různé, zejména organické látky s pufračním účinkem, a akvárium jako systém pak funguje jako pufr.