Príprava mikroskopických preparátov, alebo ako vyťažiť z domáceho mikroskopu čo najviac
Určite si každý z nás spomína na hodiny prírodovedy či biológie, prípravu tzv. senného nálevu a pozorovanie nálevníkov – črievičky veľkej či meňavky veľkej…
Stále viac akvaristov vlastní doma svetelný mikroskop, alebo uvažuje o jeho kúpe. Nejde pritom iba o tzv. „mikroskopy“ z plastu, určené pre deti v cene pár eur, ktoré sú v ponuke hračkárstiev a hypermarketov. Sú to okrem rôznych typov starších školských alebo laboratórnych mikroskopov aj mikroskopy pomerne kvalitných značiek, ako napr. Bresser, ktoré sa často objavujú na rôznych e-shopoch a možno ich vídať aj v akciových ponukách niektorých z obchodných reťazcov. Ich cena je prijateľná a dostupná aj pre bežného užívateľa a pohybuje sa od niekoľkých desiatok eur až po niekoľko stoviek eur v závislosti od značky, konštrukcie a vybavenia.
Aby však bolo možné mikroskop naplno využiť, je potrebné si vedieť správne pripraviť preparát, ktorý chceme pod ním pozorovať, či už ide o pozorovanie za účelom zistenia pôvodcu ochorenia, alebo „iba“ pozorovanie z akéhosi záujmu vidieť, čo všetko sa v našom akváriu nachádza a je to pred bežným pohľadom skryté. Rovnako potrebné je aj vedieť správne pozorovať a nastaviť si mikroskop tak, aby sme pozorovaný objekt videli čo najlepšie a najostrejšie.
Cieľom tohto článku je dosiahnuť to, aby majitelia takýchto mikroskopov, napriek tomu, že nemajú vzdelanie v odboroch zahrňujúcich mikroskopiu (histológia, mikrobiológia a pod.), neostali iba pri príprave preparátu nanesením pár kvapiek na podložné sklíčko, ale aby v rámci svojich možností dokázali vyťažiť z mikroskopu maximum, ktoré im ponúka.
Vzhľadom k tomu, že doma nemáme vybavenie na prípravu preparátov, aké sa používa v mikrobiologických a histologických laboratóriách (mikrotom, autotechnikon, termostat a pod.), budú niektoré návody značne improvizované a prispôsobené, aby mohli byť prevediteľné aj v domácich podmienkach. Treba brať pritom do úvahy, že takéto úpravy postupov môžu byť, alebo sú na úkor kvality výsledných preparátov.
1. Príprava podložného sklíčka
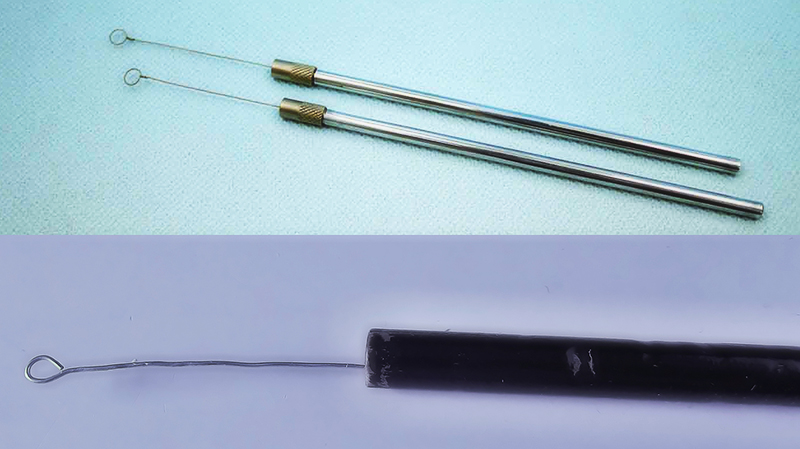
Pred zhotovením samotného preparátu by sme si mali pripraviť podložné sklíčka. Najprv je ich potrebné riadne vyčistiť a naleštiť pomocou liehu. Následne, ak ideme pripravovať preparát na pozorovanie mikroorganizmov, ich tesne pred použitím dekontaminujeme pretiahnutím párkrát nad plameňom (môžeme použiť napr. plynový sporák, prípadne plynovú pájkovačku). Takýmto spôsobom by sme mali dekontaminovať aj tzv. bakteriálnu kľučku (kovovu!) – nástroj, ktorým nanášame vzorku na podložné sklíčko.
V prípade histologických preparátov – rezov – upravíme povrch podložného sklíčka nanesením tenkej vrstvy zmesi glycerínu (mali by mať v lekárni, v ktorej pripravujú liečivá) s vaječným bielkom v pomere 1:1 (na sklíčko dáme 1 kvapku zmesi, ktorú prstom rozotrieme po celom sklíčku).
(Foto: Martin Štelzer)
2. Príprava preparátov
Pri základnom rozdelení môžeme preparáty rozdeliť na dve skupiny – natívny preparát a fixovaný preparát. Ďalej môžeme preparáty rozdeliť podľa spôsobu prípravy na celkové (napr. jednobunkové organizmy), roztlakové preparáty a nátery (napr. rastlinné preparáty na pozorovanie delenia, krvné nátery, nátery exsudátu, hlienu a pod.), rezy a výbrusy (napr. histologické rezy z tkanív, výbrus kosti a zubov). Ďalším rozdelením je rozdelenie podľa spôsobu odberu materiálu: punkcie, biopsie, nekropsie, stery, výtery, zoškraby atď.
My sa v tomto článku budeme venovať preparátom rozdeleným podľa základného rozdelenia.
2.1 Druhy preparátov
2.1.1 Natívny preparát
V natívnom preparáte pozorujeme živé bunky v neporušenom stave, kde môžeme okrem ich tvaru, veľkosti a obsahu pozorovať aj ich prípadný pohyb, rast a množenie. Takýto preparát nájde svoje využitie hlavne v oblasti mikrobiológie, kde môžme sledovať rôzne baktérie, kvasinky, mikromycéty, riasy alebo aj parazity. Svoje uplatnenie nájde aj v iných odvetviach zoológie a botaniky, napríklad pri určovaní druhov a ich taxonomického zaradenia.
Ich príprava je jednoduchá a ak sa prenesieme do prostredia akvaristov, tak aj najbežnejšia (pozorovanie machov, rias, siníc, rozsievok a pod., ale aj ikier, vajíčok slimákov a i.). Nevýhodou natívneho preparátu je však jeho trvanlivosť. Takýto preparát je nutné si vždy pripraviť tesne pred pozorovaním a nie je možné si ho odložiť a neskôr sa k nemu vrátiť.
Pozorovaný objekt stačí umiestniť do kvapky vody alebo fyziologického roztoku (vytvoríme suspenziu) a dávať pozor, aby nám počas pozorovania nevyschol. Obzvlášť pri príprave natívnych preparátov mikroorganizmov používame prednostne fyziologický roztok (je ho možné kúpiť v lekárni). Fyziologický roztok (0,9% roztok NaCl) je isotonický a pri jeho použití nedochádza k poškodeniu buniek vplyvom osmotického tlaku. Naproti tomu voda (destilovaná) vytvára hypotonické prostredie, čo spôsobuje zvýšený príjem vody bunkou, ktorá postupne zväčšuje svoj objem, až praská.
Pripravený preparát môžeme opatrne prikryť krycím sklíčkom, pričom musíme dávať pozor, aby nám pri prikrývaní nevznikali bublinky. Tie môžu pôsobiť rušivo pri pozorovaní preparátu pod mikroskopom. Ak sa stane, že nám nejaké vzniknú, môžme ich odstrániť opatrným tlakom na krycie sklíčko, čím ich z preparátu vytlačíme. Ak je potrebné, môžeme dopĺňať pri použití krycieho sklíčka vodu tzv. priesakovou metódou. K jednému okraju krycieho sklíčka dáme kvapku vody alebo fyziologického roztoku a z druhého okraja opatrne odsajeme pomocou savého papiera pôvodnú vodu, čím dôjde k „nasatiu“ pridanej vody pod krycie sklíčko.
Ďalším spôsobom prípravy natívneho preparátu je tzv. pozorovanie vo visutej kvapke. Tento spôsob je oproti tzv. „stlačenej kvapke“ (spôsob opísaný vyššie) vhodnejší najmä vtedy, keď potrebujeme preparát sledovať dlhšiu dobu, počas ktorej chceme zachytiť rast, pohyb, delenie buniek a pod. (Silnejší tlak krycieho sklíčka na preparát spomaluje pohyb mikroorganizmov.)
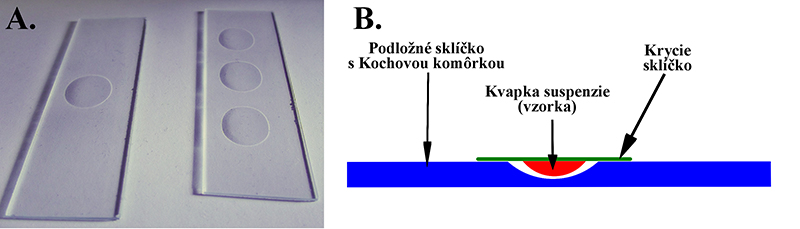
Pri tomto spôsobe budeme potrebovať špeciálne podložné sklíčko s vybrúsenou komôrkou (tzv. Kochova komôrka) (obr. 2.), prípadne si môžeme komôrku pripraviť prilepením „krúžka“ napr. z odrezanej rúrky (vznikne tzv. Böttcherova komôrka) na bežné podložné sklíčko. Pri tejto druhej komôrke si môžme v domácich podmienkach pomôcť improvizovane napr. pomocou nerezovej podložky.
Preparát pripravíme nanesením kvapky suspenzie na krycie sklíčko. Okolo vybrúsenej jamky, prípadne na prilepený prstenec nanesieme trochu vazelíny. Následne môžeme postupovať dvomi spôsobmi. 1. Podložné sklíčko priložíme ku kryciemu tak, aby bola kvapka uprostred komôrky (príp. jamky), jemne pritlačíme a následne rýchlym pohybom sklíčko pretočíme tak, aby krycie sklíčko s kvapkou suspenzie bolo na vrchu. 2. Krycie sklíčko opatrne pretočíme kvapkou smerom dolu a pritlačíme k podložnému sklíčku tak, aby kvapka so suspenziou bola umiestnená v strede vytvorenej komôrky.
2.1.2 Fixovaný preparát
Vo fixovanom preparáte pozorujeme štruktúru a jej zmeny pri patologickom procese. Fixácia je rýchle usmrtenie bunky, pri ktorom zabránime následným posmrtným zmenám (autolýze). Z tohoto dôvodu je potrebné dodržať čo najkratší predfixačný čas, t.j. čas medzi odobratím tkaniva, resp. úhynom organizmu, z ktorého pochádza, a jeho umiestnením do fixačnej tekutiny.
Preparát (príp. vzorku tkaniva) môžeme fixovať fyzikálne (napr. rýchlym zmrazením so súčasným vysušením vo vákuu, teplom) alebo pomocou kvapalných chemikálií (napr. metanol, acetón, formaldehyd, fixačné zmesi) a ich pár. V tomto článku si bližšie preberieme tie spôsoby, ktoré sú dostupné aj v domácich podmienkach pre bežného užívateľa – laika.
a) Fixácia teplom
Tento spôsob fixácie sa využíva hlavne v mikrobiológii pri pozorovaní mikroorganizmov. Jeho prevedenie je rýchle a jednoduché, avšak má niekoľko úskalí, na ktoré je potrebné dávať pozor, aby sa nám preparát pri fixovaní neznehodnotil.
Najskôr na podložné sklíčko nanesieme suspenziu (vzorku) skúmaného materiálu a kľučkou ju rozotrieme v tenkej vrstve po väčšej ploche. Vzorku necháme dôkladne zaschnúť. Preparát sa potom fixuje buď opakovaným pretiahnutím cez plameň kahana (v domácich podmienkach môžme improvizovane použiť horák plynového sporáka) alebo pomalým zahriatím nad plameňom kahana (sporáku) po dobu asi 1 minúty. V oboch prípadoch pri fixácii dbáme na to, aby strana sklíčka s preparátom smerovala hore, t.j. smerom od plameňa. Tiež je potrebné sledovať teplotu pri fixácii, aby sa materiál neprehrial. Kontrolu robíme priložením „prázdnej“ strany sklíčka k hrbátu ruky, pričom sklíčko má byť zahriate iba tak, aby dotyk bol „znesiteľný“. Nedostatočné zaschnutie preparátu pred fixáciou a vysoká teplota pri fixácii môžu spôsobiť vznik artefaktov, nesprávny výsledok farbenia, prípadne úplne znehodnotenie celého preparátu.
b) Fixácia acetónom
Tento spôsob fixácie môžme využiť ako alternatívu fixácie metanolom, ktorá je bežne používaná pri príprave zmrazených rezov a náterov (acetón je menej toxický a dostupnejší). Po zhotovení náteru sa preparát nechá zaschnúť a ponorí sa do acetónu na 2–10 minút. Acetón je dobré pred použitím nechať vychladiť v mrazničke na teplotu -20 °C. Po fixácii sa nechá preparát vyschnúť pri izbovej teplote.
Pri práci s acetónom nezabúdame, že ide o prchavú a silne horľavú látku, ktorá v zmesi so vzduchom tvorí výbušné pary.
c) Fixácia etanolom
Tento spôsob nie je príliš vhodný, pretože môže spôsobovať zmrštenie tkaniva/buniek stratou vody a tukov. Využíva sa hlavne ako náhrada formaldehydu pri príprave makroskopických preparátov orgánov a tkanív.
d) Fixácia formaldehydom
Ide o najpoužívanejší spôsob fixácie, hlavne pri príprave histologických a anatomických (makroskopických) preparátov. Používame 4–10% roztok pripravený zriedením koncentrovaného (40%) roztoku tečúcou vodou (nie destilovanou!). V takto pripravenom roztoku je potrebné neutralizovať vzniknutú voľnú kyselinu (kys. mravčia vzniká oxidáciou formaldehydu) pomocou bielej školskej kriedy (pre domáce použitie najjednoduchší spôsob), ktorú vhodíme vcelku do roztoku. Môžeme ju nalámať na menšie kúsky, prípadne podrviť, čím sa zvýši aktívny povrch.
Fixačný roztok pripravujeme vopred, keďže je potrebné kriedu nechať pôsobiť niekoľko dní. Pred použitím opatrne zlejeme potrebné množstvo roztoku. Ak sme kriedu podrvili, je vhodné roztok pred použitím prefiltrovať.
Namiesto kriedy môžeme voľnú kyselinu neutralizovať aj pomocou pufračných roztokov. Keďže formaldehyd je dráždivý a potencionálny karcinogén, pracujeme s ním v dobre vetranej miestnosti, pri práci používame ochranné rukavice a uchovávame ho v dobre uzatvorenej nádobe.
Samotnú fixáciu robíme ponorením vzorky (v našom prípade napr. celá ryba, prípadne jej časť) do fixačnej tekutiny na dostatočne dlhú dobu (jeden a viac dní v závislosti na veľkosti a druhu vzorky). V prípade anatomických preparátov je možné vzorku vo formole uchovávať trvale v dobre utesnenej nádobe.
V literatúre sa môžeme stretnúť s názvom formol, čo je 40% roztok formaldehydu. V tomto prípade môže príst pri príprave potrebných roztokov k značným chybám.
V takomto prípade je nutné prepočítavať roztoky podľa pravidla 40% formaldehyd = 100% formol, t.j. 10% roztok formolu = 4% roztok formaldehydu. Toto je dôležité rozlišovať obzvlášť pri príprave fixačného roztoku, nakoľko príliš vysoká koncentrácia má za následok stvrdnutie a znehodnotenie fixovaného tkaniva.

2.2 Celkový preparát
Celkové preparáty sú preparáty pri ktorých pozorujeme celé organizmy, napr. jednobunkové riasy a sinice, prvoky, parazity. Väčšinou ide o natívne preparáty mikroorganizmov.
Príprava celkového preparátu je jednoduchá. Na podložné sklíčko nanesieme kvapku vody alebo fyziologický roztok, do ktorého nanesieme pozorovaný objekt / objekty.
2.3 Rozter a náter
Tieto preparáty sa pripravujú rozotretím suspenzie pozorovaných buniek (baktérie, prvoky, krvné elementy) do tenkej vrstvy na podložnom sklíčku buď pomocou bakteriálnej kľučky (rozter), alebo druhého podložného sklíčka (náter). Spravidla ide o fixované preparáty, ktoré môžeme následne podľa potreby zafarbiť príslušným farbením. V rámci akvaristiky môžeme tento spôsob prípravy využiť napr. pri zisťovaní prítomnosti parazitov alebo plesní v stere alebo zoškrabe z kože rýb, prípadne pri dôkaze parazitov vo výkaloch rýb.
Pri príprave rozteru postupujeme nasledovne: do stredu podložného sklíčka nanesieme malú kvapku vody, do ktorej bakteriálnou kľučkou nanesieme suspenziu buniek. Následne kvapku rozotrieme kľučkou krúživými pohybmi po väčšej ploche sklíčka aby sme získali čo najtenšiu vrstvu. Preparát po zaschnutí fixujeme vhodnou fixačnou metódou.
Náter pripravujeme podobným spôsobom. K spodnému okraju sklíčka nanesieme kvapku suspenzie (krvi, exsudátu, bakteriálnej suspenzie a pod.), opatrne priložíme hranu druhého sklíčka ku kvapke, čím sa nám roztiahne po celej šírke sklíčka. Rýchlym ťahom po podložnom sklíčku zhotovíme náter (obr. 5.). Po vyschnutí preparát fixujeme.
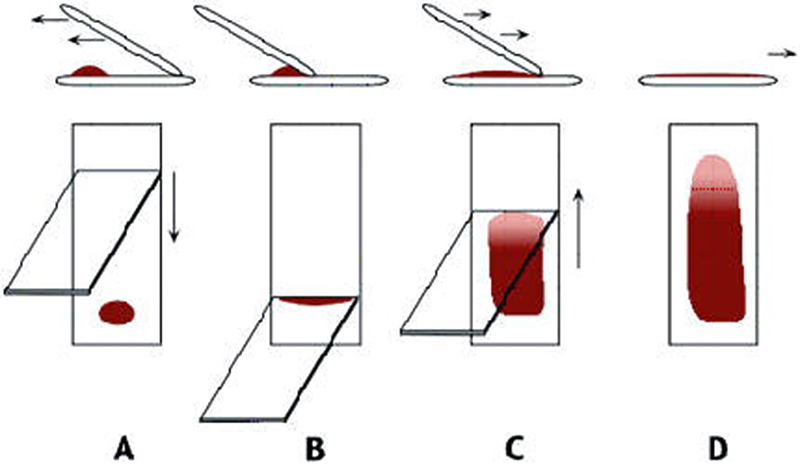
2.4 Roztlakový preparát
Roztlakový preparát sa využíva hlavne v botanike pri pozorovaní mitózy a chromozómov. Pripravuje sa, ako už aj samotný názov napovedá, rozmačknutím pozorovaného materiálu do jednej tenkej vrstvy buniek. Na podložné sklíčko nakvapkáme vodu alebo fyziologický roztok, do ktorého prenesieme kúsok tkaniva alebo časť rastliny. Následne priložíme na vrch ďalšie podložné sklíčko alebo krycie sklíčko a tlakom pripravíme preparát.
Pri príprave dávame pozor, aby nám sklíčka pri rozmačknutí nepraskli, obzvlášť pri použití krycieho sklíčka, ktoré je z veľmi tenkého skla (0,13–0,2 mm).
2.5 Histologické rezy
Príprava rezov z tkaniva je najčastejším spôsobom prípravy preparátov v histológii. Táto metóda je však značne zložitejšia a zdĺhavejšia oproti predchádzajúcim spôsobom, hlavne pokial chceme pripravovať rezy z mäkkých tkanív.
Oproti roztlakovým preparátom však štruktúra tkaniva ostáva zachovaná a môžeme tak pozorovať aj patologické zmeny, ktoré túto štruktúru menia (napr. fibróza). Tento spôsob prípravy preparátov môžeme využiť pri pozorovaní stavby (morfológie) tela rýb, ale aj pri diagnostike niektorých ochorení, kde jednak môžeme sledovať prítomnosť patogénov vo vnútorných orgánoch, ale aj ich morfologické zmeny (napr. stukovatenie pečene, rozpad žiabier a pod.).
Pri príprave rezov používame podložné sklíčka upravené vrstvou glycerín-bielku (nanesením tenkej vrstvy zmesi glycerínu s vaječným bielkom v pomere 1:1), s výnimkou niektorých špeciálnych farbení.
Aby bolo možné z tkaniva zhotoviť tenké rezy (hrúbka bežných histologických preparátov sa pohybuje v rozmedzí cca 4–20 μm), je potrebné ho zaliať do látky, ktorá dobre vyplní všetky mikroskopické štrbiny a po stuhnutí je dobre rezateľná. V laboratórnej praxi sa najčastejšie používa zalievanie do parafínu (s vynimkou kostí a zubov, kde ho je možné použiť iba v kombinácii s dekalcifikáciou), menej často do celloidínu alebo želatíny a iných médií. Vzhľadom k technickej náročnosti zalievania do parafínu (potrebné niekoľkohodinové presýtenie tkaniva rozpusteným parafínom pri teplote 56 °C) je v domácich podmienkach vhodnejšie zvoliť spôsob zalievania do želatíny. I v tomto prípade však budeme musiet improvizovať, nakoľko pri tomto spôsobe je v laboratóriu potrebné na krájanie rezov použiť zmrazovací mikrotóm (kryostat).
Príprava rezov z tkanív zaliatych do želatíny pozostáva z niekoľkých, na seba nadväzujúcich krokov:
- Fixácia a získanie excízie – malej časti tkaniva
- Vypieranie
- Zalievanie do želatíny
- Rezanie
V našich improvizovaných podmienkach môžeme rezy z rastlinných pletív a tuhších tkanív (po fixácii a vypieraní fixačnej tekutiny, viď pokračovanie článku) pripraviť jednoducho odrezaním veľmi tenkého plátku (snažíme sa o čo najtenšie rezy) pomocou žiletky. Toto upustenie od zalievania však môže byť na úkor kvality takto pripravených výsledných preparátov. Žiletku používame vždy novú, pretože aj okom neviditeľné naštrbenia nám môžu preparát znehodnotiť (obr. 6B, C). Rez je potrebné viesť jedným smerom, a pokiaľ je to možné, jedným ťahom (nie „pílkovito“).
Jedným zo spôsobov je aj príprava rezu pomocou čerstvo zlomeného skla, podobne ako sa používa pri príprave ultratenkých rezov pre potreby elektrónovej mikroskopie.
Namiesto fixácie a presýtenia niektorým z médií sa v niektorých prípadoch používa príprava tzv. zmrazených rezov (napr. pri peroperačnej biopsii, pri použití niektorých špeciálnych farbiacích metód a pod.). Príprava takýchto rezov je však technicky náročná, preto sa týmto spôsobom nebudeme v článku zaoberať.
1. Fixácia a získanie excízie
Pri príprave histologických preparátov sa používa väčšinou ako fixačná tekutina formol, ale je možné použiť aj iné druhy fixačných roztokov (tie majú však svoje značné obmedzenia) a zmesí (Bouinova tekutina, Zenkerova tekutina, Carnoyova tekutina, alkohol-formol a pod.). Niektoré farbenia vyžadujú použitie konkrétnej fixačnej zmesi, avšak s týmito metódami sa v domácich podmienkach zaoberat nebudeme.
Objem fixačnej tekutiny by mal byť aspon 10-násobne väčší ako objem fixovanej vzorky. Dĺžka fixačného času závisí od použitej fixačnej tekutiny (vzhľadom na rozdielnu schopnosť prenikania do tkanív), ako aj od veľkosti a druhu fixovanej vzorky, a môže sa tak pohybovať v rozmedzí niekoľkých minút (30–60) až po niekoľko týždňov. V niektorých prípadoch môžeme dobu fixácie urýchliť zahriatím fixačnej tekutiny (napr. formolu) na teplotu okolo 37 °C, čo spôsobí lepšie prenikanie fixačnej tekutiny do tkaniva.
Pri získavaní excízie musíme narábať s materiálom opatrne, aby nedošlo k jeho zmačkaniu a iným mechanickým poškodeniam (platí aj pri ďalšej manipulácii s tkanivom), ktoré by nám materiál znehodnotili a stal by sa pre histologické hodnotenie nepoužiteľným (obr. 6D). Spravidla pri odbere používame planžetu alebo skalpel.
Materiál nesmie byť pred spracovaním zmrazený (s výnimkou rýchleho zmrazenia tekutým dusíkom alebo suchým ľadom), rovnako nesmie prísť k zmrazeniu ani počas jeho spracovania (napr. vo fixačnej tekutine). Pomalé zmrazovanie spôsobuje tvorbu kryštálikov ľadu vo vnútri buniek a v tkanive a následne ich poškodenie vplyvom zväčšujúceho sa objemu (obr. 6E, F).
Ak získavame excíziu pre diagnostické účely, je dôležité odobrať vzorku z reprezentatívnej časti tkaniva (t.j. z časti, kde je predpoklad patologických zmien) tak, aby bola zároveň podľa možností zachytená aj časť okolitého patologickým procesom nezmeneného tkaniva.
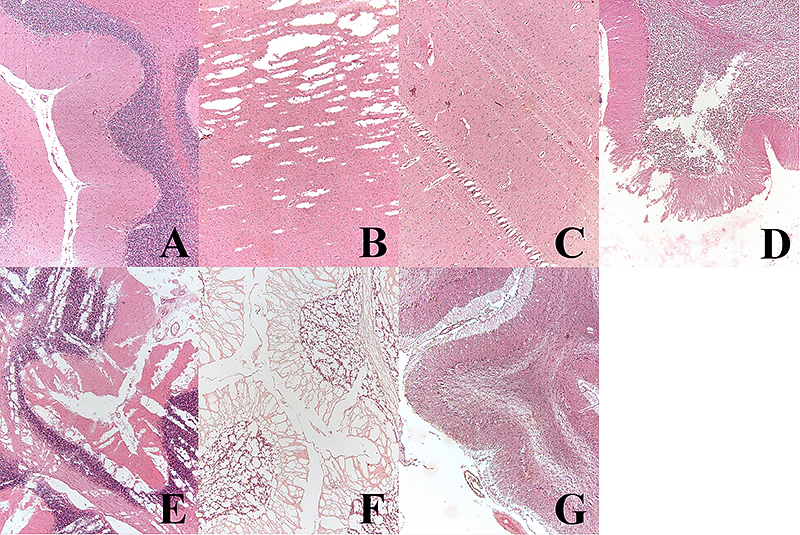
A) kontrolný preparát bez významných zmien (mozoček, farbenie hematoxylínom a eozínom /H&E/, 50x zväčšenie);
B) preparát poškodený tupou planžetou (kôra mozgu, H&E, 100x);
C) preparát poškodený naštrbenou planžetou (kôra mozgu, H&E, 100x);
D) mechanické poškodenie tkaniva pri spracovaní (mozoček, H&E, 50x);
E) materiál znehodnotený pomalým zmrazením pred fixáciou (mozoček, H&E, 50x);
F) materiál zmrazený vo fixačnej tekutine (formol) (mozoček, H&E, 50x);
G) tkanivo zmenené patologickým procesom (mozoček, H&E, 50x).
(Foto: Martin Štelzer)
2. Vypieranie
Aby sme mohli odobratý materiál ďalej spracovať, je potrebné ho zbaviť fixačnej tekutiny. Zostatková fixačná tekutina (hlavne formol) nám môže pri farbení vytvárať s použitým farbivom zrazeniny.
Ak sme použili pri fixácii formol, je potrebné tkanivo vypierať tečúcou vodou po dobu niekoľkých hodín (cca 4–6). Keďže v domácich podmienkach by nám rodinný príslušníci takéto vypieranie pravdepodobne netolerovali, môžeme ho prevádzať tak, že tkanivo umiestníme do väčšej nádoby s vodou (z vodovodu) a tkanivo vypierame pomocou častejších výmen vody a občasným premiešaním. Pri takomto spôsobe je však nutné predĺžiť čas prepierania a taktiež musíme počítať s tým, že nevylúčime možnosť prítomnosti zostatkovej fixačnej tekutiny.
Zalievanie do parafínu
Napriek tomu, že tento spôsob spracovania materiálu je pomerne zdĺhavý a technicky dosť náročný, si ho popíšeme vzhľadom k tomu, že zalievanie do parafínu je najčastejším spôsobom prípravy tkanivových bločkov v histológii.
Než pristúpime k samotnému zaliatiu tkaniva do parafínu, musíme tkanivo najskôr odvodniť pomocou vzostupnej rady alkoholov (parafín nie je miešateľný s vodou), presýtit tzv. intermédiom (látka miešateľná s odvodňujúcim aj so zalievacím médiom) a následne postupne presýtit zalievacím médiom, ktorým je v tomto prípade parafín. Ako intermédium sa najčastejšie používa postupný rad acetón – acetón-xylén (1:1) – xylén.
V laboratóriu sa na tento účel používa prístroj – autotechnikón, ktorý nám zabezpečí presun vzoriek medzi jednotlivými médiami a dodržanie naprogramovaných časových intervalov. Postup si však môžeme zjednodušiť a prispôsobiť pre manuálne spracovanie.
Samotný upravený postup si popíšeme v jednotlivých bodoch:
- 1. 70% alkohol – 1 hodina
- 2. 96% alkohol – cez noc
- 3. 100% alkohol (96 %-ný alkohol dehydrovaný bezvodým CuSO4 /t.j. vyžíhaný CuSO4·5H2O do biela, účinnosť stráca po zmodrení/) – 2 hodiny
- 4. acetón – 1 hodina
- 5. acetón-xylén – 1 hodina
- 6. xylén – 2 hodiny
- 7. Parafín 54-56°C – 3 x 3 hodiny (vždy vymeniť za čistý)
- 8. Zaliať do parafínu vo formičke (napr. papierovej) a nechať dôkladne stuhnúť pri izbovej teplote
Etanol, potrebný pre spracovanie, môžeme použiť buď čistý, alebo denaturovaný (napr. benzínom). Pri presýtení parafínom a zalievaní teplota nesmie presiahnúť 58°C, pretože pri vyšších teplotách dochádza k stvrdnutiu a znehodnoteniu tkaniva.

(Foto: Martin Štelzer)


(Foto: Martin Štelzer)

3. Zalievanie do želatíny [1]
Tento spôsob sa v praxi používa hlavne pri spracovaní riedkych tkanív (placenta, sliznica čreva), ktoré sa následne krájajú pomocou zmrazovacieho mikrotómu. Pre domáce, značne improvizované podmienky je to však najjednoduchší spôsob. Upravený postup pre domáce improvizované použitie si taktiež popíšeme v jednotlivých bodoch:
- Presýtenie 10% vodným roztokom želatíny pri 37 °C – 2 hodiny
- Presýtenie 15% vodným roztokom želatíny pri 37 °C – 2 hodiny
- Zaliatie do 20% vodného roztoku želatíny v komôrke (napr. papierová škatuľka)
- Vytvrdnutie v 4–8% formaldehyde – 24 hodín
- Zamrazenie tkanivového bločku pri teplote -20°C (bežná teplota v mrazničke) pred rezaním
4. Rezanie
Aby bolo možné preparáty pozorovať pod mikroskopom, je potrebné docieliť dostatočne malú hrúbku, aby mohlo cez ne prechádzať svetlo. Toto dosiahneme tým, že z pripraveného tkanivového bločku odrežeme veľmi tenký plátok, ktorý umiestnime následne na pripravené podložné sklíčko. Rez opatrne podlejeme niekoľkými kvapkami destilovanej vody a zahriatím sklíčka od spodnej strany na teplotu približne 56 °C rez vyrovnáme (napínanie a lepenie). Po vyrovnaní vodu spod rezu opatrne odsajeme pomocou savého papiera (vreckovka, buničitá vata a pod.). Ako už bolo spomenuté vyššie, na rezanie používame žiletku a snažíme sa o čo možno najtenšie rezy, ideálne v hrúbke 1, max. niekoľkých (2–3) vrstiev buniek. V laboratórnej praxi sa k tomuto účelu používa mikrotom – zariadenie, ktoré vďaka velmi jemnému a presnému posunu bločku umožňuje vytvárať rezy s hrúbkou už od niekoľkých tisícin milimetra.
Kedže doma nemáme zmrazovací mikrotom ani kryostat, rezy z bločkov zaliatých do želatíny zhotovujeme ihneď po vybratí z mrazničky, skôr ako príde k ich rozmrazeniu.

(Foto: Martin Štelzer)
(Foto: Martin Štelzer)
3. Farbenie preparátov
Vzhľadom k tomu, že pripravené preparáty sú priesvitné a jednotlivé štruktúry nie sú dobre v bežnom mikroskope rozoznateľné (bol by potrebný mikroskop s fázovým kontrastom), je potrebné ich pred samotným pozorovaním zafarbiť. K tomuto účelu používame farbivá (prirodzené alebo umelé) alebo impregnácie pomocou ťažkých kovov. Pri niektorých používaných metódach (najmä histochemických) dochádza k zafarbeniu vplyvom reakcie farbiaceho roztoku s niektorou zložkou v preparáte (napr. Perlsova reakcia na dôkaz Fe3+ v tkanivách).
Farbenia si môžeme rozdeliť podľa jednotlivých kritérií a postupov:
Podľa určenia:
- orientačné, prehľadné farbenia
- diagnostické, špeciálne farbenia
Podľa spôsobu farbenia [2]:
- progresívne – farbenie jedným farbivom do žiadaného zafarbenia
- regresívne – tkanivo najprv cielene prefarbíme a následne diferencujeme (odfarbujeme) do cieleného zafarbenia
- sukcesívne – tkanivo farbíme dvoma alebo viacerými farbivami po sebe, pričom každé farbí inú zložku tkaniva (napr. jedno farbivo farbí jadro, druhé cytoplazmu)
- simultánne – tkanivo farbíme zmesou rôznych tkanív, pričom jednotlivé zložky sa zafarbia podľa toho, ku ktorému farbivu majú väčšiu afinitu
- substantívne – tkanivo farbíme farbivom priamo
- adjektívne – tkanivo farbíme pomocou moridla, ktoré použijeme buď pred samotným farbením, alebo v zmesi so samotným farbivom
- in toto – farbí sa excízia pred zaliatím do média
Podľa spôsobu, akým sa preparáty farbia, môžme rozdeliť farbenia aj na pozitívne (farbia sa bunky a zložky farbiva) a negatívne (farbí sa pozadie, bunky a zložky ostávajú nezafarbené). Negatívne farbenie sa využíva najmä v mikrobiológii napr. pri farbení bakteriálnych púzdier (farbenie podľa Buriho).
Podľa výsledku farbenia [2]:
- difúzne – všetky zložky sú zvýraznené rovnako
- efektívne – niektoré zložky sa farbením viac zvýraznia, prípadne sa farbia ako jediné
- ortochromatické – tkanivo je zafarbené v jednom odtieni použitého farbiva
- metachromatické – jednotlivé zložky sú zafarbené v rôznych odtieňoch použitého farbiva
Farbivá používané pri príprave preparátov rozdeľujeme na:
- bázické (zásadité) – obsahujú zásadité radikály. Zložky tkaniva, ktoré majú afinitu k týmto farbivám (kyslé zložky bunky), nazývame ako bazofilné. Sem patrí najmä jadro bunky, resp. chromatín obsiahnutý v jadre bunky. Príkladom takéhoto farbiva je hematoxylín, metylénová modrá, malachitová zelená a iné.
- kyslé (plazmatické) – obsahujú kyslé radikály. Zložky tkaniva, ktoré majú afinitu k týmto farbivám (zásadité zložky bunky), nazývame ako oxifilné, príp. eozinofilné podľa eozínu, ktorý je najčastejšie používaným kyslým farbivom. Sem patrí najmä cytoplazma väčšiny buniek. Príkladom takéhoto farbiva je eozín, metylová modrá (nie metylénová!) a iné.
- neutrálne – obsahujú kyslé aj zásadité radikály. Patria sem napr. lipofilné farbivá, napr. sudan.
Niektoré zložky tkanív sa farbivami buď nefarbia vôbec, alebo sa rovnako (slabo) intenzívne farbia ako kyslými, tak aj bázickými farbivami. V tomto prípade hovoríme o neutrofílii, resp. neutrofilných zložkách.
V tomto článku si uvedieme iba niektoré, najviac používané alebo najdostupnejšie spôsoby farbenia preparátov. Niektoré z látok, ktoré k nim budeme potrebovať, sú ľahko dostupné (napr. ako liečivá v akvaristike: metylénová modrá, malachitová zelená, alebo ako školské potreby: tuš), iné sú zohnateľné v lekárni, prípadne prostredníctvom známych, ktorí pracujú v laboratóriách. Prípadne môžete poprosiť vyučujúcich na rôznych školách, či by vám neposkytli malé množstvo (aj mnoho základných a stredných škôl má vo vyučovaní zahrnuté aj laboratórne cvičenia, kde sa niektoré z týchto látok používajú).
3.1 Farbenie natívnych preparátov
Pre lepšie zvýraznenie niektorých bunkových štruktúr sa používajú tzv. vitálne farbivá. Sú to vodné roztoky niektorých farbív vo veľmi nízkej koncentrácii (< 0,01 %). Napriek ich zriedeniu môžu vykazovať pre bunky určitú toxicitu.
Rozlišujeme prísne vitálne (intravitálne) farbenia (farbenie živých neporušených buniek, napr. prvokov, prípadne sa farbivo aplikuje priamo do živého organizmu), supravitálne (prežívajúce bunky vyňaté z organizmu) a postvitálne (farbenie odumierajúcich buniek).
Medzi vitálne farbivá patrí napríklad metylénová modrá (Golgiho aparát, nervové zakončenia, jadrá odumierajúcich buniek prvokov), Janusova zeleň (mitochondrie), neutrálna červeň (vakuoly), metylénová violeť (mitochondrie) a iné.
Vitálne farbenie metylénovou modrou [3,4]
Toto farbenie sa používa najčastejšie ako test vitality kvasiniek v potravinárstve. Využíva sa pritom to, že odumreté bunky kvasiniek narozdiel od živých ľahko prijímajú pridané farbivo. Ďalším využitím tohto farbenia je pozorovanie tvorby potravinových vakuol v bunkách prvokov, napr. u črievičky veľkej v sennom náleve.
Príprava roztoku metylénovej modrej: 0,1 g metylénovej modrej rozpustíme v 30 ml 96% etanolu, pridáme 0,1 ml 10% roztoku KOH a doplníme 100 ml destilovanej vody.
Pri vitálnom farbení používame iba malé množstvo (malú kvapku) zriedeného farbiva, ktoré pridávame k natívnemu preparátu s použitím krycieho sklíčka priesakovou metódou, ktorú som opísal vyššie v časti o príprave natívneho preparátu. V našich domácich podmienkach je možné použiť aj zriedený roztok metylénovej modrej, ktorý dostaneme kúpiť v akvaristike ako liečivo.
3.2 Farbenie fixovaných mikrobiologických preparátov
V mikrobiológii používame pre farbenie fixovaných preparátov orientačné farbenia (monochromatické, farbené jedným farbivom), ktoré nám demonštrujú iba prítomnosť a tvar baktérií bez bližšej klasifikácie, a diagnostické farbenia (používame niekoľko druhov farbív na jeden preparát), ktoré nám pomôžu v bližšom určení druhu baktérie.
Preparáty pripravujeme ako roztery alebo nátery, ktoré fixujeme teplom. Pre lepšiu manipuláciu pri farbení je vhodné si pripraviť misku, do ktorej budeme zlievať použité kvapaliny. Do vnútra misky vložíme buď stojan na sklíčka, alebo na vrch misky položíme mriežku, na ktorú môžeme ukladať farbené preparáty. Vzhľadom na to, že pri farbení používame aj organické rozpúšťadlá (napr. acetón), stojan aj miska by mala byť z materiálu, ktorý je voči týmto látkam odolný (bežnú plastovú misku používanú v kuchyni by acetón rozleptal).

(Foto: Martin Štelzer)
Orientačné farbenie metylénovou modrou podľa Löfflera [2]
Príprava roztoku metylénovej modrej: 0,3 g metylénovej modrej rozpustíme v 30 ml 96% etanolu, pridáme 0,1 ml 10% roztoku KOH (alebo NaOH) a 100 ml destilovanej vody. Oproti vitálnemu farbeniu používame koncentrovanejší roztok pre lepšiu viditeľnosť. Pri vitálnom farbení musíme zohľadniť toxicitu farbiva.
Postup farbenia je jednoduchý. Na vychladnutý fixovaný preparát nakvapkáme dostatočné množstvo farbiaceho roztoku a necháme pôsobiť 3 minúty. Následne farbivo opatrne zlejeme, preparát opláchneme tečúcou alebo destilovanou vodou a necháme vysušiť. Preparát pozorujeme pod imerziou (s použitím imerzného oleja) – viď nižšie v kapitole 4.
Farbenie podľa Grama [5]
Toto farbenie je základné diagnostické farbenie používané v bakteriologickej diagnostike. Podľa farbiteľnosti podľa Grama rozdelujeme baktérie na gram pozitívne (G+) a gram negatívne (G-). Rozdielna farbiteľnosť je spôsobená rozdielmi v stavbe bunkovej steny u G+ a G- baktérii. Okrem týchto dvoch typoch bunkovej steny poznáme ešte tretí typ bunkovej steny, ktorú majú tzv. acidorezistentné baktérie. Tie ostávajú pri tomto farbení bezfarebné.
Farbenie podľa Grama má niekoľko modifikácií, my si v tomto článku bližšie popíšeme iba jeho základný, najčastejšie používaný spôsob. Namiesto karbolfuchsínu, ktorý sa používa najviac, pre dofarbenie G- baktérií použijeme neutrálnu červeň, ktorej príprava je jednoduchšia.
Príprava roztokov:
Roztok kryštálovej violeti: 1 g kryštálovej violeti sa rozpustí v 40 ml 96% etanolu pri teplote 37 °C. Roztok sa prefiltruje cez filtračný papier a pridá sa k nemu 1% sfiltrovaný vodný roztok šťavelanu amónneho v pomere 1:4 (1 diel roztoku kryštálovej violeti a 4 diely roztoku šťavelanu amónneho). Roztok sa uchováva v tmavej fľaši.
Lugolov roztok: 1 g jódu sa rozpustí v 200 ml 1% vodného roztoku jodidu draselného. Roztok sa uchováva v dobre uzavretej tmavej fľaši.
Neutrálna červeň: 1 g neutrálnej červene sa rozpustí v 100 ml destilovanej vody.
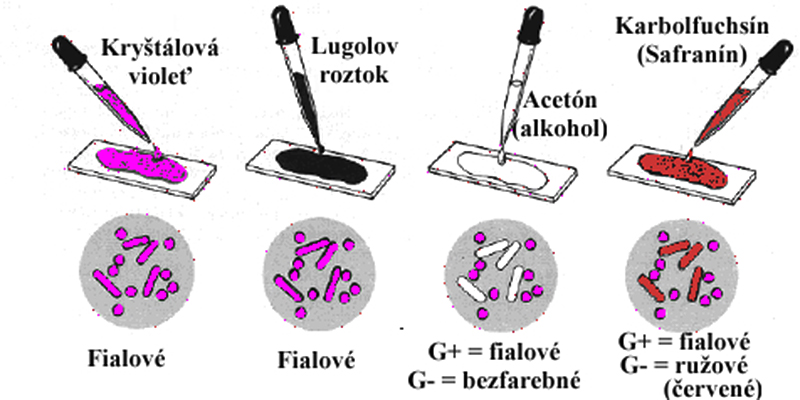
Postup farbenia (hviezdičkou sú označené najčastejšie používané roztoky):
- Bázické farbivo (20 s): kryštálová violeť* (syn. Genciánová violeť alebo metyl violeť 10B).
- Opatrne zliať farbivo.
- Morenie preparátu (20 s): Lugolov roztok (vzniká komplex kryšt. violeti a jódu). Najprv opatrne opláchnuť preparát Lugolovým roztokom a následne ho ním navrstviť.
- Opatrne zliať Lugolov roztok.
- Odfarbenie (20 s): alkohol, acetón*, alebo alkoholacetón 1:1.
- Opatrne opláchnuť vodou.
- Dofarbenie (30–60 s): Karbolfuchsín*, safranín alebo neutrálna červeň.
- Opatrne opláchnuť vodou a nechať preparát dôkladne vysušiť.
Preparát pozorujeme pod imerziou.
(Zdroj: [8])
Pre lepšie zapamätanie si postupu farbenia študentom vždy radíme pomôcku VLAK alebo VLAS: Violeť, Lugol, Acetón/Alkohol, Karbolfuchsín/Safranín.
Poznámka: Všetky kvapaliny vždy pridávať a zlievať z podložného sklíčka jedným smerom! Najlepšie je sklíčko nadvihnúť na jednej strane cca pod 45° uhlom a kvapalinu nechať stiect dolu do pripravenej nádobky. Rovnakým spôsobom preparáty aj premývame – tekutinu lejeme na vrchný kraj sklíčka a nechávame ju stekať po sklíčku do pripravenej nádobky. Pri farbení podľa Grama používame zriedené roztoky farbív.
Výsledok: G- baktérie sú sfarbené do ružova až červena, G+ baktérie sú sfarbené do modrofialova.
Najčastejšie chyby:
- v preparáte sú zrazeniny alebo kryštáliky farbív (ak farbíme ešte teplý fixovaný preparát, ak sme všetky použité roztoky nezlievali a preparát neoplachovali rovnakým smerom, ak je zle prefiltrované farbivo)
- mikroorganizmy sú slabo zafarbené (ak odfarbujeme acetónom príliš dlho)
- G+ baktérie sa javia ako G- (ak náter nebol dostatočne vysušený pred fixáciou, ak sa použije stará kultúra, ak je poškodená bunková stena baktérií)
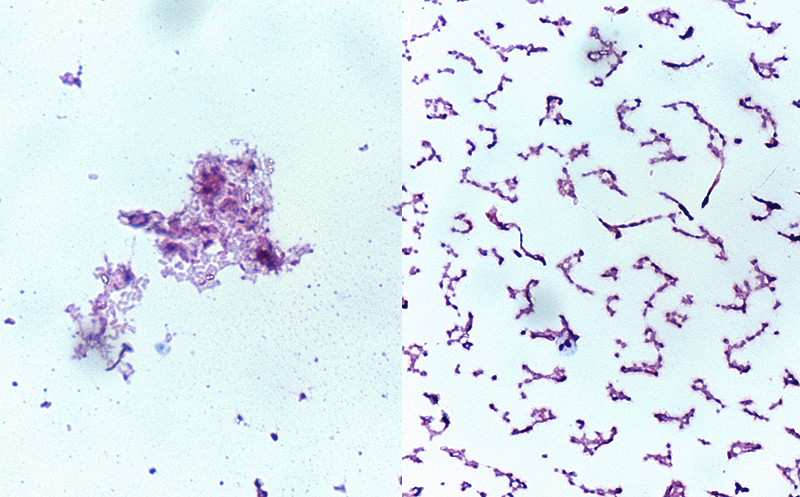
(Foto: Martin Štelzer)
3.3 Farbenie náterov
Okrem mikrobiologického vyšetrenia sa náterové a rozterové preparáty používajú pre rôzne cytologické vyšetrenia buniek (napr. pri podozrení na nádorové bujnenie, hodnotenie tvaru a počtu buniek v krvnom nátere a pod.). Jedným z najčastejšie používaných farbení je farbenie podľa Giemsa, ktorým je možné okrem krvných elementov znázorniť niektoré parazity – prvoky (Protozoa), ako aj niektoré baktérie a veľké vírusy. Na fixáciu sa najčastejšie používa metanol alebo acetón.
Farbenie podľa Giemsa
Farbenie podľa Giemsa sa používa hlavne v parazitológii na mikroskopický dôkaz parazitov. Giemsovo farbivo má tri zložky: azur B, azur II-eosin a metylénovú modrú. Farbivo je dostupné aj v práškovej forme, ale vzhľadom na postup prípravy a potrebu látok, ktoré nie sú ľahko dostupné (metanol), je výhodnejšie získať priamo farbiaci roztok.
Postup samotného farbenia je jednoduchý. Vyschnutý fixovaný preparát ponoríme do farbiaceho roztoku, prípadne ho ním prevrstvíme a necháme pôsobiť 20–30 minút. Následne preparát dôkladne opláchneme vodou a necháme vyschnúť. Preparát môžeme pozorovať pod imerziou, alebo ho môžeme uzavrieť krycím sklíčkom pomocou montovacieho média (viď nižšie v kapitole 4.).
3.4 Farbenie histologických preparátov
Tak ako pri mirobiologických preparátoch, tak aj v histológii môžeme rozdeliť farbenia na dve skupiny – prehľadné a špeciálne.
Prehľadné farbenia slúžia na orientačné znázornenie štruktúr tkaniva a prípadných patologických zmien.
Špeciálnymi farbeniami a impregnáciami znázorňujeme konkrétne cieľové štruktúry (napr. myelinizované výbežky neurónov), anorganické (napr. Fe3+) a organické látky (napr. polysacharidy), pigmenty, enzýmy a pod.
Na rozdiel od mikrobiologických orientačných farbení, v histológii môžu byť orientačné, ale aj špeciálne farbenia monochromatické, alebo polychromatické.
3.4.1 Príprava preparátu pred vlastným farbením
Aby sme mohli narezané a usušené preparáty farbiť, musíme ich ešte upraviť. Táto úprava spočíva z odstránenia zalievacieho média z tkaniva (hlavne pri zalievaní do parafínu alebo iných vo vode nerozpustných médií) a zavodnenia tkaniva, vzhľadom na to, že väčšina používaných farbív je rozpustných vo vode.
V prípade zaliatia tkaniva do želatíny stačí preparát dobre premyť v destilovanej vode, aby sa z neho želatína odplavila. V prípade zalievania do parafínu je potrebné rezy odparafínovať xylénom; následne xylén, ktorý je nemiešateľný s vodou, odstránime z tkaniva zostupnou radou alkoholov a nakoniec tkanivo zavodníme kúpelom v destilovanej vode. Je potrebné dávať pozor, aby nám rezy pred vlastným farbením ani počas neho opätovne nevyschli.
Postup odparafínovania rezov zaliatych do parafínu:
- xylén – krátky oplach
- xylén – 10 min.
- 96% alkohol – oplach
- 96% alkohol – 5 min.
- 70% alkohol – 5 min.
- destilovaná voda – 5 min. (v prípade, že sa vo vode vytvorí biely zákal, treba ju vymeniť až do úplneho vyčírenia)

(Foto: Martin Štelzer)
3.4.2 Vlastné farbenie
V histologickej technike existuje veľmi veľké množstvo rôznych prehľadných a špeciálnych farbení a impregnácií. My si vyberieme iba niektoré, ktoré môžeme použiť aj v akvaristike pri hľadaní možných príčin ochorenia. Najčastejšie používaným je farbenie hematoxylínom a eozínom. Ďalšie farbenie, ktoré si spomenieme, je histochemické farbenie polysacharidov reakciou PAS (Periodic acid – Schiff) podľa McManusa. Okrem nich môžeme použiť aj niektoré farbenia, ktoré sa používajú v mikrobiológii (napr. orientačné farbenie metylénovou modrou, farbenie podľa Grama a jeho modifikáciu podľa Browna a Brenna pre farbenie baktérií v tkanivách) alebo pri cytologickom farbení náterov (napr. farbenie podľa Giemsa).
Prehľadné farbenie hematoxilínom a eozínom
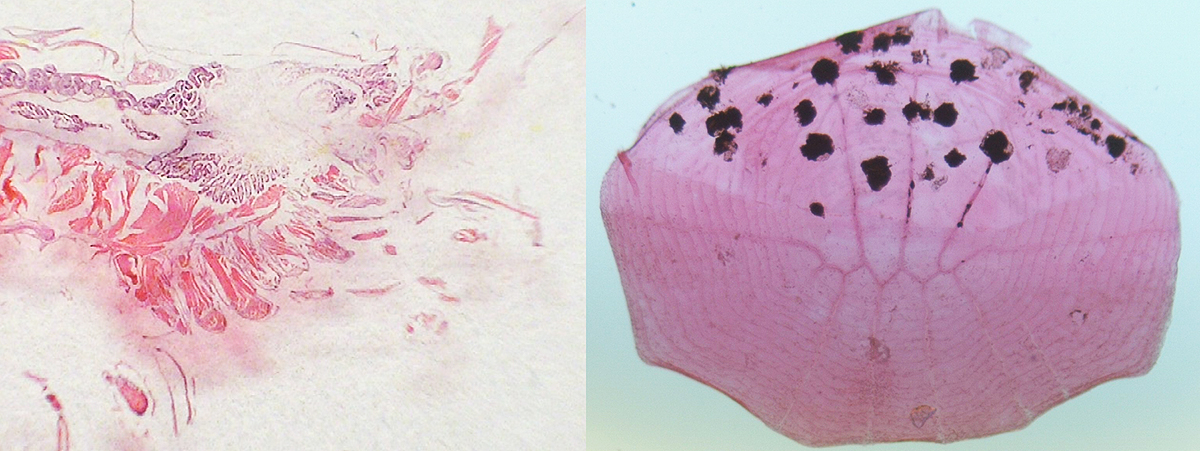
Ako už bolo vyššie spomenuté, ide o najčastejšie používané rutinné orientačné farbenie v histológii. Toto farbenie nám poskytuje prehľad o morfológii tkaniva, ale je ním možné znázorniť aj niektoré patologické znaky a prítomnosť niektorých pôvodcov nákazy (napr. parazity).
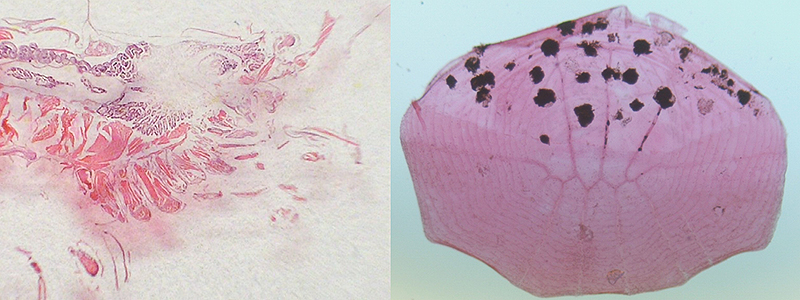
vpravo šupina (celá) Trigonostigma heteromorpha s viditeľnými pigmentovými bunkami (zväčšenie 50x).
(Foto: Martin Štelzer)
Príprava roztokov:
Roztok Mayerovho hematoxylínu (vzhľadom na zložitosť postupu je vhodnejšie si zaobstarať už hotový roztok):
- 2,1 g hematoxylínu / 100 ml horúcej destilovanej vody.
- Po vychladnutí doplniť do 1800 ml destilovanou vodou.
- Nechať stáť 1 týždeň.
- Pridať 100 g KAl(SO4)2 – síran hlinito-draselný.
- Premiešať a nechať stáť 1 týždeň.
- Po rozpustení pridať 0,4 g NaIO3 – jodičnan sodný.
- Nechať stáť 1 týždeň.
- Pridať 100 g chloralhydrátu.
- Nechať stáť 1 týždeň.
- Pridať 2 g kys. citrónovej.
– roztok je možné použiť opakovane
Roztok 1% eozínu: 1 g eozínu rozpustiť v 100 ml dest. vody
– roztok je možné použiť opakovane
Karbol-xylol
– zmes xylénu a fenolu v pomere 9:1, fenol pridávať do xylénu!!!
Postup farbenia:
- Mayerov hematoxylín – 5 min.
- Tečúca voda – 10 min. (zmodrenie rezov)
- Destilovaná voda – oplach
- 1% eozín – 1–1,5 min.
- 96% alkohol – oplach
- 96% alkohol – diferencovanie (odstránenie prebytočného farbiva)
- Karbol-xylol – 5 min.
- Prejasnenie (presýtenie xylénom), montovanie
Výsledok farbenia: Jadrá sa farbia na modro, cytoplazma a ostatné štruktúry sa farbia v rozličných odtieňoch ružovej až červenej farby.

(Foto: Martin Štelzer)
Histochemický dôkaz polysacharidov PAS podľa McManusa [2]
Toto farbenie je možné využiť aj v akvaristike pri znázornení prítomnosti vláknitých mikromycét (plesne) a kvasiniek vďaka tomu, že vo svojej bunkovej stene obsahujú polysacharidy. Okrem histologických rezov môžme farbiť aj napr. rozterové preparáty zo steru získaného z povrchu rýb.
Príprava roztokov:
Roztok kyseliny jodistej: 0,5 g kys. jodistej sa rozpustí v 100 ml destilovanej vody.
Schiffov roztok:
- 1,5 g bázický fuchsín práškový
- 8 ml absolútneho etanolu
- 190 ml destilovanej vody
- za stáleho miešania zahriať na 45 °C
- po vychladnutí na 20 °C pridať 5 g pyrosiričitanu sodného
- 3,5 ml konc. HCl
- 0,3 g hydrosiričitanu sodného
- 2 g aktívneho uhlia (môže sa pridať aj viac)
- premiešať a nechať 24 hodín stáť
- prefiltrovať (filtrát musí byť číry, bezfarebný – ak nie je, musí sa opakovať proces s aktívnym uhlím /pridať nové aktívne uhlie, premiešať a nechať stáť/ až do úplného vyčírenia)
- roztok uchovávame v chladničke; použiteľný je, pokiaľ zostáva číry
Postup farbenia:
- Oxidácia 0,5% roztokom kys. jodistej – 5 min.
- Destilovaná voda – oplach
- Schiffov roztok – 20 min.
- Premývanie v tečúcej vode – 20 min.
- Dofarbenie jadier Mayerovým hematoxylínom – 5 min.
- Premývanie v tečúcej vode – 10 min.
- Oplach v destilovanej vode
- Odvodnenie vzostupnou radou alkoholov (70% alkohol – 1 min., 96% alkohol – 1 min.)
- Vysušenie, prejasnenie, montáž
(Poznámka: body 5–7 je možné podľa potreby vynechať.)
Modifikácia Gramovho farbenia podľa Browna a Brenna [2]
Pri tejto modifikácii postupujeme rovnako ako pri farbení mikrobiologických preparátov. Zmena oproti pôvodnému postupu nastáva pri dofarbení, kde je použitý namiesto karbolfuchsínu zriedený bázický fuchsín. Rezy následne diferencujeme roztokom kyseliny pikrovej v acetóne.
Vo výsledku sú G+ baktérie tmavofialové, G- baktérie a jadrá sú ružovočervené a na rozdiel od pôvodného farbenia je pri tejto modifikácii cytoplazma žltá, svalové tkanivo a fibrín sú žltočervené.
Príprava roztokov:
Zásobný roztok bázického fuchsínu: 0,25 g bázického fuchsínu sa rozpustí v 100 ml destilovanej vody.
Pracovný roztok bázického fuchsínu: 0,1 ml zásobného roztoku, 100 ml destilovanej vody.
Diferenciačný roztok: 0,1 g kyseliny pikrovej, 100 ml acetónu.
Postup farbenia:
- Kryštálová violeť – 2 min.
- Premytie preparátu v dest. vode – 1 min.
- Lugolov roztok – 1 min.
- Opláchnutie v tečúcej vode
- Odfarbenie acetónom, kým odchádza prebytočné farbivo z rezov
- Dofarbenie roztokom bázického fuchsínu – 5 min.
- Rýchle opláchnutie v acetóne
- Diferencovanie v diferenciačnom roztoku až sú rezy žltoružové. Prebytočný fuchsín musí byť odstránený z tkaniva, ale G- baktérie a jadrá ostanú ružové (kontrola pod mikroskopom).
- Oplach v acetóne
- Oplach v acetón-xyléne 1:1
- Prejasnenie v xyléne, montáž
4. Pozorovanie preparátov
Pripravené a prípadne zafarbené preparáty môžeme pod mikroskopom pozorovať dvoma spôsobmi. Tzv. suchým systémom – uzatvorením krycím sklíčkom (najčastejšie pri histologických rezoch) alebo v kvapke vody bez ponorenia objektívu – a mokrým systémom, ponorením objektívu do kvapky vody alebo imerzného oleja (najčastejší spôsob pri mikrobiologických preparátoch a krvných náteroch).
V zásade platí, že suchý systém sa používa pri pozorovaní objektov menším zväčšením (objektívy so zväčšením 4 – 60x) a mokrý systém sa používa pri pozorovaní veľmi malých objektov (napr. baktérií), kde je potrebné použitie väčšieho zväčšenia (najčastejšie objektívy so zväčšením 100x), keďže pri mokrom systéme dosahujeme vyššiu rozlišovaciu schopnosť.
Objektívy, ktoré je možné použiť pri mokrom systéme, sú označené pri olejovej imerzii nápismi Ol. im, Oil, Oel, pri vodnej imerzii WI, Water, Wasser. Použitie iných objektívov pri pozorovaní mokrým systémom sa neodporúča, pretože môže prísť k ich poškodeniu.
Výsledné zväčšenie, akým pozorujeme preparáty, zistíme vynásobením zväčšenia objektívu a okuláru. T.j. ak si na mikroskope nastavíme objektív s 20-násobným zväčšením a okulár máme s 10-násobným zväčšením (najčastejšie), výsledné zväčšenie pozorovaného objektu bude 200-násobné.
Uzatvorené preparáty [1]
Aby sme získali trvalé preparáty, uzatvárame ich podložným sklíčkom pomocou montovacích médií. Sú to látky, ktoré sú dokonale priehľadné, s vysokým indexom lomu (približne rovnakým ako sklo) a ktoré nepoškodzujú sfarbenie a štruktúru preparátu. Montovacie médiá môžu byť rozpustné v xyléne (kanadský balzam, Entelan, Pertex a pod.), alebo rozpustné vo vode (glycerín, glycerínová želatína, Apáthyho sirup a pod.). Výber média je potrebné zvážiť podľa použitého farbenia.
Pri použití médií, ktoré sú rozpustné v xyléne (najčastejšie používané) je potrebné preparát najskôr odvodniť vzostupným radom alkoholov (70%, 96%), usušiť (príp. použiť napr. karbol-xylol pri niektorých farbeniach) a prejasniť v xyléne.
Vodou rozpustné médiá používame v zásade vtedy, ak tkanivo nesmie prísť do styku s organickými rozpúšťadlami (napr. pri dôkaze tukov). Vtedy však musíme okraje krycieho sklíčka po uzatvorení preparátu utesniť napr. pomocou asfaltového laku.
Krycie sklíčko môžeme použiť aj pri pozorovaní natívnych preparátov, vtedy však nepoužívame montovacie médiá.
Pozorovanie preparátov pod imerziou
Pri imerznom pozorovaní preparátov kvapneme imerzný olej (syntetický, alebo cédrový) buď priamo na vyschnutý preparát, alebo na krycie sklíčko. Pri súčasnom sledovaní zboku makroskrutkou dvihneme mikroskopický stolík s preparátom tak, aby sa imerzný objektív ponoril do kvapky oleja a takmer sa dotkol preparátu. Ak máme mikroskop vybavený kondenzorom (väčšina mikroskopov), je vhodné irisovú clonu otvoriť na maximum. Obraz následne zaostríme pomalým oddialovaním preparátu mikroskrutkou pri súčasnom pohľade do okuláru. Zaostriť obraz je možné aj pomalým približovaním, avšak pri tomto spôsobe je riziko prasknutia podložného sklíčka prílišným priblížením, čo môže mať za následok aj úraz.
Po skončení mikroskopovania oddialime objektív od pozorovaného preparátu a objektív dôkladne očistíme, pretože zaschnutie imerzného oleja na optike mikroskopu môže viesť k jej znehodnoteniu.
(Foto: Martin Štelzer)
5. Príklad praktického využitia
V našom akváriu sme objavili, že ryby majú akoby zakalený povrch kože. Chceme si overiť/zistiť, či ide o ochorenie vyvolané mikróbom (napr. Ichthyobodo necatrix), alebo fyzikálnym, prípadne chemickým faktorom (pH, otrava amoniakom).
Postup:
- Vylovíme postihnutú rybu.
- Odoberieme ster z povrchu ryby pomocou vatového tampónu alebo urobíme zoškrab pomocou bakteriálnej kľučky, prípadne špachtle alebo podložného sklíčka a pripravíme rozter (kap. 2.3) na vopred pripravenom a dekontaminovanom podložnom sklíčku – kap. 1. Odber vzorky zo živých rýb je zložitejší a vzhľadom na možnosť vzniku sekundárnej infekcie po odbere je potrebné urobiť príslušné opatrenia, aby sme tomu predišli.
- Pripravený preparát fixujeme teplom (kap. 2.1.2a) alebo acetónom (kap. 2.1.2b)
- Preparát zafarbíme prehľadným farbením. Môžme si vybrať medzi niekoľkými farbeniami, napr. farbenie metylénovou modrou podľa Löfflera (kap. 3.2), farbenie podľa Giemsa (kap. 3.3), alebo farbenie hematoxylínom a eozínom (kap. 3.4).
- Preparát pozorujeme pod mikroskopom – kap. 4. (V prípade Ichthyobodo necatrix môžeme zvoliť pozorovanie preparátu suchou cestou /preparát prejasníme xylénom a uzatvoríme krycím sklíčkom/ pri všetkých farbeniach vzhľadom k tomu, že tento prvok je viditeľný už pri 400x zväčšení. Ak by sme chceli použiť väčšie zväčšenie a pozorovať preparát pod imerziou, pri farbení podľa Löfflera alebo Giemsa preparát nie je nutné uzatvárať krycím sklíčkom.)
Aby sme však vedeli, čo na preparáte hľadáme, je potrebné si vždy naštudovať, ako daný mikroorganizmus či poškodenie tkaniva vyzerá. K tomuto účelu môžeme použiť rôzne atlasy a fotografie prístupné na internete.
Literatúra:
- [1] Vacek, Z. (1990): Histológia a histologická technika. Osveta, 504 pp.
- [2] Čunderlíková, M. et Balážová, V. (1990): Vybrané kapitoly z histologickej techniky. Osveta, 170 pp.
- [3] Praktický průvodce mikrosvětem I. [online] [cit. 2.6.2015] Dostupné na mikrosvet.mimoni.cz/ulohy/107-kvasinky
- [4] INFOVEK – pokusy – prvoky. [online] [cit. 2.6.2015] Dostupné na www.infovek.sk/predmety/biologia/pokusy/prvoky.php
- [5] Záhradnický, J. et al (1991): Mikrobiológia a epidemiológia II. Osveta, 1991, 222 pp.
- [6] coolcolourexperiments.blogspot.sk/2013/06/cool-colour-experiments-flame-test.html
- [7] www.geocities.ws/mtjaved_uaf/system1.jpg
- [8] www.medschool.lsuhsc.edu/Microbiology/DMIP/dmex05.htm